Uncategorized
Покази для звертання в медико-генетичну консультацію
(Medical Genetic Counseling)
Любов Євтушок
Лікар-генетик
Рівненського обласного клінічного лікувально-діагностичного центру
Тетяна Власишина
вчитель ЗОШ № 15
м. Рівне
Що таке медико-генетичне консультування?
Медико-генетичне консультування – це процес обміну інформацією щодо проблем, пов’язаних з наявністю або ризиком виникнення генетичної хвороби в особи/родини. Під час консультації лікар має допомогти пацієнту/родині:
- проаналізувати медичну інформацію, включаючи встановлений діагноз, можливий перебіг хвороби та прийнятні методи лікування;
- оцінити ступінь впливу генетичних факторів на перебіг хвороби та ризик виникнення хвороби в певних членів родини;
- усвідомити альтернативи щодо зменшення ризику виникнення хвороби;
- вибрати найбільш прийнятний спосіб лікування відповідно до існуючого ризику, етичних, релігійних переконань, мети, що поставила перед собою особа/родина;
- забезпечити найкращий з існуючих спосіб лікування хвороби і/або поінформувати про способи зниження рекурентного ризику.
Що дає медико-генетичне консультування?
Медико-генетичне консультування дозволяє лікарям не тільки діагностувати хворобу, але й надавати пацієнтам конкретні рекомендації щодо лікування. Згідно з отриманими результатами, лікарі-генетики можуть направляти пацієнтів до спеціалістів вузького профілю, повідомляти їм про існування спеціальних дослідницьких програм, визначати родинні групи підтримки та надавати інформацію про освітні, громадські, соціальні служби і джерела фінансування для осіб з такими хворобами.
Результати генетичної оцінки, як правило, повідомляються безпосередньо під час консультації(й), коли лікар-генетик пояснює діагноз, якщо він встановлений, характер та етіологію порушення, передісторію, прогноз, шлях успадкування та рекурентний ризик. Рівень консультації має відповідати освітньому рівню пацієнта. Лікар-консультант повинен відповідати на запитання якомога повніше. Стандартним вважається непрямий режим проведення генетичної консультації.
Якщо генетична консультація проводиться в медико-генетичному центрі, то консультованому видається медичний висновок з поясненням діагнозу та результатами проведення клінічних та лабораторних досліджень.
Етапи медико-генетичного консультування:
Медико-генетичне консультування починається з визначення осіб/родин групи ризику. Далі йде етап встановлення діагнозу, спілкування з родиною, залучення провідних спеціалістів для характеристики медичного аспекту хвороби та надання родині інформації, що допомагає усвідомити ризик виникнення хвороби і існуючі альтернативи. Підтвердження діагнозу й оцінка будь-яких змін стану вимагає проведення подальших досліджень. В процесі проведення медико-генетичного консультування лікарі повинні чітко усвідомлювати межу своїх можливостей і надавати необхідну підтримку родині.
Покази до проведення преконцепційної та пренатальної медико-генетичної консультації:
- Зрілий вік матері (35 та більше років під час пологів).
- Занепокоєння щодо можливого репродуктивного ризику у будь-якому віці.
- Позитивний результат маркерного скринінг-тесту сироватки крові вагітної (множинний маркерний скринінг).
- Кровна спорідненість чи інцест.
- Численні викидні (три та більше), повторні аборти та/чи мертвонародження.
- Хромосомні перебудови в одного з батьків/інших родичів.
- Анамнез чи народження попередньої дитини з хромосомною аномалією (наприклад, синдром Дауна, Трисомія 18, Трисомія 13, синдром ламкої Х-хромосоми).
- Вроджене порушення метаболізму (підозра на вроджене порушення метаболізму) в одного з батьків чи попередньої дитини (наприклад, фенілкетонурія, хвороба кленового сиропу, галактоземія, синдром Гурлера, лактацидоз, хвороба Тея-Сакса).
- Попередня дитина зі значною структурною аномалією (наприклад, вада невральної трубки, вроджена вада серця, розщілина губи і піднебіння).
- Попередня дитина з хворобою невизначеного анамнезу (наприклад, розумова відсталість, мертвонародження, неонатальна смерть).
- Наявність в одного з батьків чи попередньої дитини відомої генетичної аномалії (наприклад, недосконалий остеогенез, нейрофіброматоз, міотонічна дистрофія, туберозний склероз).
- Пренатально діагностовані аномалії у плода (наприклад, ізольована (множинна) мальформація(ї), водянка, олігогідрамніон, затримка росту плода невідомої етіології, вада невральної трубки).
- Вплив тератогенів під час вагітності (наприклад, алкоголь, парвовірус, краснуха, певні антиконвульсанти, акутан).
- Ураження матері певними хворобами, що впливають чи можуть вплинути на розвиток плода та/або результат вагітності (такі як діабет, алкоголізм, хвороба сполучної тканини, фенілкетонурія).
- Один з батьків є носієм, має родинну передісторію чи входить до етнічної або расової групи ризику хвороби, що може бути діагностовано завдяки пренатальному тестуванню (наприклад, хвороба Тея-Сакса, муковісцидоз, спінальна м’язова атрофія, прогресуюча м’язова дистрофія Дюшенна, синдром ламкої X-хромосоми, гемофілія А, фенілкетонурія).
Покази до проведення медико-генетичного консультування в ранньому дитинстві та дитинстві:
- Одна (чи більше) велика вроджена мальформація(ї) (така як розщілина верхньої губи та піднебіння, омфалоцеле, енцефалоцеле, редукційні вади кінцівок).
- Малі аномалії або неспецифічні незвичні риси, що є ознаками потенційно розпізнаного синдрому чи мальформації невизначеного типу (наприклад, преаурикулярні ямки, ниркова дисплазія і втрата слуху при бронхо-ото-ренальному синдромі; ямки на губі при синдромі Ван дер Вуда).
- М’язова гіпотонія невизначеного генезу, особливо в неонатальний період.
- Кома, блювота, летаргія, метаболічний ацидоз невизначеного генезу, гіперамоніємія, кетоз, судоми, гіперглікемія, гіпо/гіперкальціемія або інші комбінації метаболічних ознак та симптомів без чітко встановлених причин.
- Гепатоспленомегалія, грубі риси обличчя, множинний дизостоз невизначеного генезу.
- Кардіоміопатія невизначеного походження.
- Підтверджена/виявлена в процесі скринінгу новонароджених аномалія (наприклад, фенілкетонурія, вроджений атиреоз, галактоземія, серповидно-клітинна хвороба).
- Інші відомі або можливі метаболічні порушення, такі як гомоцистинурія, вітамін D-резистентний рахіт.
- Невідповідний віку розвиток або інші ознаки нейродегенеративної хвороби.
- Розумова відсталість, затримка розвитку і/або аутизм невизначеної етіології.
- Значне погіршення слуху, що викликане іншими, ніж перенесена інфекція, менінгіт та травмування, причинами.
- Погіршення зору, не враховуючи незначні рефракційні порушення чи косоокість (наприклад, вроджені катаракти, атрофія зорового нерву невизначеного походження, паличкова/колбочкова дистрофія, пігментний ретиніт, колобома, відшаровування сітківки).
- Незвичний стан шкіри (наприклад, пігментні дисплазії, іхтіоз, бульозні порушення, родимі плями, чисельні гемангіоми, рубцювання, пухлини шкіри).
- Пухлини/злоякісні утвори, до яких є ймовірна генетична схильність (наприклад, ретінобластома, нефробластома, гліома очей, карцинома наднирників).
- Затримки розвитку, росту/мальформації в немовляти або дитини, що викликані ймовірним впливом тератогенів (наприклад, алкоголю, кокаїну).
- Дитина з короткою статурою, що не відповідає зросту інших членів родини з явною кістковою дисплазією чи без неї.
- Незвичність показників росту (а саме, надлишковий зріст, асиметричність, макросомія та диспропорційність) з переліку яких, після проведення первинних скринінг-тестів, потрібно виключити випадки, викликані відомими причинами чи ті, що, ймовірно, мають ендокринну етіологію.
- Невизначеність статі або інші аномалії геніталій.
- Відома чи можлива спадкова хвороба або наявність в родинному анамнезі такої ж самої хвороби (наприклад, м’язова дистрофія, гемофілія).
- Відома хромосомна аномалія.
- Новонароджені з аномалією чи затримкою росту, що виявлені пренатально.
- Мертвонароджені або померлі немовлята з відомими або ймовірними внутрішніми чи зовнішніми аномаліями (наприклад, водянка, затримка росту плода, мальформації, карликовість, ниркова дизгенезія/агенезія, гістологічні показники, що надають можливість припускати метаболічні порушення).
Покази до проведення медико-генетичного консультування в підлітковому віці та після досягнення повноліття:
- Одна (чи більше) велика вроджена мальформація(ї), така як розщілина губи та/або піднебіння, вада невральної трубки, вроджена вада серця.
- Малі мальформації або неспецифічні незвичні фізичні риси, що є ознаками синдрому, який потенційно можливо розпізнати чи мальформації невідомого зразка (наприклад, міопія, розщілина губи та лійкоподібна деформація грудної клітини при синдромі Стіклера).
- Затримка розумового розвитку невизначеної етіології.
- Погіршення зору, не враховуючи прості рефракційні порушення чи косоокість (наприклад, атрофія зорового нерву, паличкова/колбочкова дистрофія, пігментний ретиніт, колобома, відшарування сітківки, зміщені кришталики).
- Незвичний стан шкіри (наприклад, пігментні дисплазії, іхтіоз, бульозні порушення, родимі плями, гемангіоми, рубцювання, чисельні пухлини шкіри).
- Значне погіршення слуху, що почалося в ранньому дитинстві чи в підлітковому віці.
- Безпліддя невідомої етіології або чисельні викидні (три та більше) з невідомих причин.
- Відсутність сім’явиносних протоків.
- Передчасна недостатність яєчників.
- Медичний стан з потенційним ризиком впливу тератогенів, що потребує надання преконцепційної консультації матері (наприклад, фенілкетонурія, епілепсія, алкогольна залежність, діабет).
- Особистий чи родинний анамнез щодо раку з виявленою чи можливою спадковою схильністю (наприклад, ранній рак молочної залози, ободової кишки, яєчників, ретінобластома) або декілька членів родини, що хворіють на рак.
- Особистий чи родинний анамнез з виявленою або ймовірною спадковою хворобою (наприклад, муковісцидоз, полікистозна хвороба нирок, синдром Марфана, міотонічна дистрофія, хвороба Гентінгтона, хвороба Шарко-Марі-Тута, альфа-1 антитрипсинова недостатність, схильність до раннього тромбоутворення, гемохроматоз, родинна гіперліпідемія, кардіоміопатія).
- Кожна жінка дітородного віку з особистою чи родинною наявністю хромосомної аномалії чи наявністю збалансованої хромосомної транслокації або іншої хромосомної сегрегаційної перебудови; або, якщо жінка належить до етнічної чи расової групи з підвищеним ступенем ризику виникнення певної спадкової хвороби (наприклад, серповидно-клітинна анемія в афро-американців, таласемія в мешканців Середземномор’я та південно-східної Азії, хвороба Тея-Сакса в євреїв-ашкеназі).
- Близькі родичі, що мають чи можуть мати дітей (наприклад, один з батьків та дитина, рідні брати та сестри, двоюрідні брати та сестри).
Переглянуто редакційною колегією I.B.I.S.: 11/09/2003
Генетична регуляція статі та діагностичні підходи при інтерсексуалізмі. Генетичний контроль статевого диференціювання
(Intersex – Hermaphroditism)
Н.О. Зимак
Зав. медико-генетичною консультацією
м. Хмельницький
Визначальним моментом у формуванні статі є хромосомний набір. Саме наявність гоносом (Х чи Y) обумовлює в подальшому розвиток гонад, а під впливом їх гормональної продукції відбувається формування геніталій.
Складність, багаторівневість генетичної детермінації статі визначає множинність імовірних пошкоджень та досить високу їх частоту. У найбільш загальному вигляді поняття інтерсексуалізму (чи гермафродитизму) можна визначити як невідповідність між різними складовими статі, а саме генетична-гонадна-генітальна-паспортна-психо-сексуальна).
Розрізняють істинний гермафродитизм (при якому співіснують оварільна та тестикулярна тканини), жіночий псевдогермафродитизм (стан, при якому у осіб із каріотипом 46, ХХ зовнішні геніталії маскулінізовані), чоловічий псевдогермафродитизм (чоловіча генетична стать із фемінізацією зовнішніх статевих органів).
Патогенез:
Під контролем хромосомного набору з первинної недиференційованої гонади, закладка якої відбулась на 4-му тижні ембріонального розвитку з виросту целомічного епітелію, в присутності Y хромосоми та її генного продукта, Н-Y-антигена, формується яєчко. Клітини Лейдіга яєчок продукують адрогени (місцевий тестостерон), що викликає вірилізацію Вольфових протоків (із них розвиваються сім’яні міхурці, сім’яний канатик та придаток яєчка). Дигідротестостерон, 5-альфа-редукований продукт тестостерону, діє на урогенітальний синус та генітальне підвищення, завершуючи процес нормальної маскулінізації зовнішніх геніталій. Продукований клітинами Сертолі глікопротеїн – фактор регресії Мюллерових протоків (ФРМП) спричиняє зворотний розвиток Мюллерових протоків.
При відсутності Y-хромосоми, Н-Y-антигена та його специфічного рецептора на поверхні клітин недиференційована гонада згідно з, так званою, автономною тенденцією до фемінізації з 10 тижня ембріонального розвитку диференціюється у яйник. У ембріона з нормальним жіночим каріотипом (46, ХХ) закладаються і розвиваються фолікули; у ембріона з хромосомним набором 45, Х більшість оваріальних фолікулів дегенерують до часу народження. Оскільки яєчка відсутні, ФРМП, тестостерон чи дигідротестостерон (ДГТ) не продукуються. Без ФРМП Мюллерові протоки персистують і розвиваються у матку, фаллопієві труби та склепіння піхви. За відсутності тестостерону Вольфові протоки регресують, без ДГТ зовнішні геніталії не будуть маскулінізовані повністю. Регуляторні мутації можуть призводити до активації Н-Y-антигена у плода з жіночою хромосомною статтю у випадку транслокації дистального відділу короткого плеча Y-хромосоми на одну з хромосом або переносу гена, що детермінує розвиток яєчка, з Y-хромосоми на Х-хромосому у результаті кросинговеру при мейотичному процесі у батька (“ХХ-чоловіки”).
Зачатками зовнішніх геніталій є генітальне підвищення, уретральні складки та лабіоскротальний валик, ідентичні у обох статей до 8 тижнів гестації. З 8 тижнів генітальне підвищення, уретральні складки та лабіоскротальний валик розвиваються відповідно у клітор, малі та великі статеві губи у плода жіночої статі та у кавернозні тіла, статевий член, пеніальну уретру та калитку у плода чоловічої статі. Формування порожнини піхви триває з 15 тижнів, повністю завершуючись до 18 тижнів гестації. Протягом 12-14 тижнів закінчується формування статевого члена.
Яйники плоду гормонально малоактивні, а фетальні тестикули секретують значну кількість тестостерону. У той час як формування статі було агормональним до початку синтезу андрогенів у яєчках і перебувало виключно під генетичним контролем, то далі воно стає гормональнозалежним з провідною роллю чоловічих статевих стероїдів.
Дефіцит тестостерону призводить до неповної маскулінізації зовнішніх геніталій у чоловіків, але у жінок змін зовнішніх геніталій не викликає, за винятком недостатності 3-бета-оксистероіддегідрогенази, при якій мінімальний вірилізуючий ефект виникає внаслідок підвищеного рівня ДГЕА, слабкого андрогена. Рівень тестостерону підвищується при дефіциті 21-гідроксилази чи 11-гідроксилази. Гіперпродукція тестостерону викликає вірилізацію зовнішніх геніталій у плода жіночої статі, не викликаючи відхилень від норми у плода чоловічої статі. Вплив дефіциту ензимів синтезу мінералокортикоїдів, глюкокортикоїдів, статевих стероїдів на розвиток зовнішніх геніталій у уражених плодів поданий нижче.
Клінічні форми:
- Чоловічий псевдогермафродитизм – це стан, при якому при нормальному чоловічому каріотипі 46, ХY зовнішні геніталії недостатньо вірилізовані.
- Генні форми:
- Порушення синтезу тестостерону: 5 явних аутосомно-рецесивних синдромів, результатом яких є зниження продукції тестостерону: три (дефіцит холестеролдесмолази, 3 бета-оксистероїддегідрогенази та 17-альфа-гідроксилази) є варіантами вродженої гіперплазії наднирників і проявляються дефіцитом кортизолу та тестостерону; два (17,20-десмолази та 17-оксистероїддегідрогенази дефіцит) є ферментними дефектами, що вражають переважно синтез тестостерону яєчками.
- Порушення метаболізму тестостерону: дефіцит 5-альфа-редуктази, аутосомно-рецесивно успадковуваний дефект, що призводить до зниженого рівня дигідротестостерону (ДГТ). Діагноз підтверджується нормальним рівнем тестостерону до та після тесту стимуляції ХГЛ і зниженою реакцією ДГТ, що значно (помітно) збільшує тестостерон-ДГТ коефіцієнт.
- Порушення андрогенної дії. Тестикулярна фемінізація (46, ХY), Х-зчеплений рецесивний тип успадкування, зумовлена дефектом рецептора андрогенів, при якому нечутливість як до тестостерону, так і до ДГТ, призводить до розвитку жіночого фенотипу. Оскільки ФРМП секретується фетальними тестикулами, то фалопієві труби, матка та верхня третина піхви не розвиваються. Синдром Рейфенштейна є частковим дефектом адрогенних рецепторів у фібробластах і характеризується перинеоскротальною гіпоспадією у новонароджених, азооспермією та гінекомастією у післяпубертатному віці.
- Цитогенетичні форми:
- 45,Х/46,ХY – найбільш частий тип мозаїцизму. Фенотиповий спектр широкий (від зовні нормально розвинених чоловічих чи жіночих геніталій до невизначеної статі). Термін змішаний або асиметричний гонадальний дизгенез застосовується до осіб з однією стрік-гонадою та одним дизгенетичним яєчком.
- 45,Х/47,ХYY чи 45,Х/46,ХY/47,ХYY.
- Аномалії Y хромосоми (наприклад, дицентричний Y).
- Генні форми:
- Жіночий псевдогермафродитизм – це стан, при якому у осіб з каріотипом 46,ХХ зовнішні геніталії маскулінізовані (збільшений клітор, маленький вагінальний отвір, уретра відкривається у піхву).
- Генні форми – вроджена гіперплазія наднирників – внаслідок підвищеного рівня фетальних андрогенів:
- Дефіцит 21-гідроксилази може проявлятись сіль-втрачаючою формою (повний дефіцит) чи простою вірилізуючою формою (частковий дефіцит 21-гідроксилази). Це найбільш поширені варіанти вродженої гіперплазії наднирників.
- Дефіцит 11-гідроксилази (гіпертензивна форма).
- Дефіцит 3-бета-оксистероїддегідрогенази.
- Дефіцит 20-гідроксилази, 22-гідроксилази чи 20-, 22-десмолази.
- Тератогенні форми:
- Материнські адрогени чи прогестини – андрогени та деякі прогестини можуть викликати вірилізацію жіночих геніталій на 5-10 тижні ембріонального розвитку. Після 12 тижня гестації імовірні тератогени можуть спричиняти збільшення клітора, але не лабіоскротальне зрощення. Однак, диференціація яйників чи мюллерових структур не пошкоджується андрогенами.
- Вірилізуючі (андроген-продукуючі) пухлини яйників чи наднирників можуть маскулінізувати плід жіночої статі.
- Генні форми – вроджена гіперплазія наднирників – внаслідок підвищеного рівня фетальних андрогенів:
- Істинний гермафродитизм. При істинному гермафродитизмі співіснують оварільна та тестикулярна тканини. Найбільш частий каріотип при істинному гермафродитизмі – 46,ХХ (80%), наступний за поширеністю 46,ХY (10%) та варіанти мозаїцизму, такі як 46,ХХ/46,ХY і 46,ХХ/47,ХХY (1%).
- Інші захворювання. Інтерсексуалізм може спостерігатись також і при інших умовах, як от:
- хромосомні синдроми – синдром триплоїдії, аутосомні трисомії тощо;
- множинні вроджені аномалії та мальформації:
- Аарського синдром;
- екстрофія сечового міхура;
- синдром каудальної регресії;
- Робінова синдром;
- Сміта-Лемлі-Опітца синдром;
- cиндром Меккеля;
- cиндром ВВВ;
- брахіо-скелето-генітальний синдром та ін.
Номер з каталогу МІМ:
- 400045 46,XX True Hermaphroditism
- 154230 46,XY Sex Reversal 4, SRXY4
- 312300 Androgen Insensitivity, Partial, PAIS
- 480000 Sex-Determining Region Y; SRY
- 264270 Pseudohermaphroditism, Female, with Skeletal Anomalies
- 278850 46,XX Sex Reversal 2, SRXX2
- 300068 Androgen Insensitivity Syndrome; AIS
Список літератури:
- Беникова Е.А., Бужиевская Т.И., Сильванская Е.М. Генетика эндокринных заболеваний.- Киев: Наукова думка, 1993.- С. 144-201.
- Ромеро Р., Пилу Д. и др. Пренатальная диагностика врождённых пороков развития плода. М.: Медицина, 1994.- С. 301-303.
- Harold Chen. Diagnostic Approaches to Ambiguos Genitalia (Lecture from the course of medical genetics).
Переглянуто редакційною колегією I.B.I.S.: 05/02/2002
Дивіться також:
- Новонароджена дитина з невизначеними (двозначними) геніталіями (інформація для спеціалістів)
- Новонароджена дитина з невизначеними (двозначними) геніталіями (інформація для батьків)
Гемохроматоз
(Hemochromatosis)
Д.Р. Ахмеджанова
Інформаційний спеціаліст Хмельницького ОМНІ-Центру
Що таке гемохроматоз?
Гемохромaтоз (пігментний цироз печінки, бронзовий діабет, синдром Труаз’є-Ано-Шоффара, сідерофілія) – спадкове хронічне захворювання, що характеризується порушенням обміну заліза, підвищеним його вмістом у сироватці крові та накопиченням в тканинах і внутрішніх органах у вигляді спеціальної речовини – гемосидерину. Через накопичення даної речовини шкіра отримує характерний темний відтінок – звідки і походить друга назва цього захворювання: “бронзовий діабет”.
Як часто виникає дане захворювання?
Зустрічається доволі рідко. Хворіють переважно чоловіки (співвідношення чоловіків і жінок 20:1).
Які причини його виникнення?
Виділяють первинний та вторинний гемохроматоз.
Первинний гемохроматоз відноситься до спадкових захворювань, причина яких – мутація гена (у даному випадку гена, що має назву НFE-C282Y і Н63D, який знаходиться короткому плечі хромосоми 6).
Вторинний гемохроматоз виникає при надлишковому надходженні в організм заліза (тривалому лікуванні препаратами заліза, при повторних частих гемотрансфузіях).
При первинному гемохроматозі внаслідок мутації порушений обмін речовин, при якому у тонкій кишці людини всмоктується значно більше заліза, ніж в нормі, і воно відкладається в тканинах – в печінці, підшлунковій залозі, серцевих м’язах, шкірі, як правило, у вигляді нерозчинного гемосидерину. У гладких м’язах також надлишково відкладається ліпофусцин, в епідермісі – меланін. Початок захворювання у багатьох випадках пов’язують з дією факторів зовнішнього середовища, таких як порушення харчування, вживання алкоголю чи інших токсичних речовин.
Які ознаки (симптоми) повинні насторожити щодо гемохроматозу?
Цими ознаками є:
- цукровий діабет,
- цироз печінки,
- кардіоміопатія,
- темна (бронзова) пігментація відкритих ділянок шкіри,
- гіпогонадизм (порушення статевого розвитку),
- рак печінки,
- підвищена концентрація сироваткового заліза.
Коли проявляється дане захворювання?
У дитячому віці гемохроматоз проявляється нечасто, при цьому спостерігається первинний інфантилізм, біль в ділянці печінки, в юнацькому віці формується вторинна атрофія гонад. Найчастіше клінічні ознаки захворювання з’являються у зрілому віці (після 40 років). У цьому віці гемохроматоз проявляється симптомами цукрового діабету, в 70% випадків діабет інсулінозалежний. До інших можливих ендокринних порушень відноситься дефіцит гормонів гіпофізу (гонадотропних, АКТГ, ТТГ), проявами чого є загальна слабкість, зменшення у розмірах та зниження функції статевих органів та зниження лібідо. Постійний симптом гемохроматозу – гіпертрофічний цироз печінки, колір шкіри – від металево-сірого до бронзового. Характерною ознакою є скарги на болі у різних частинах, переважно у печінці. Ураження серця виявляється тільки на ЕКГ.
Перебіг захворювання постійно прогресуючий.
Які ускладнення можуть виникнути?
Можуть виникнути такі ускладнення як печінкова та діабетична коми, асцит, серцева недостатність, аритмія, гостра кровотеча із варикозно-розширених вен стравоходу та шлунку.
Якщо гемохроматоз – спадкове захворювання, то яким чином воно передається?
Тип наслідування даного захворювання – аутосомно-домінантний, тобто воно передається із покоління в покоління.
А які ж лікувальні підходи?
Оскільки симптоми даного захворювання пов’язані з надлишком заліза, то необхідно обмежити його вживання, тобто необхідно дотримуватися дієти: намагатися не вживати продуктів, багатих на залізо. Слід уникати вживання лікарських засобів, що містять залізо, мінеральних добавок, надлишку вітаміну С, сирих морських продуктів. Для тих, хто має проблеми з печінкою, не слід вживати алкоголю. Рекомендується харчування, збагачене білком, препарати, які зв’язують залізо і сприяють його виведенню (призначаються лікарем).
Іноді доводиться вдаватись до відносно простого, недорогого, безпечного і достатньо ефективного методу лікування, що має на меті видалення надлишку заліза шляхом періодичного забору крові (так звана терапевтична флеботомія) до досягнення нормальної концентрації заліза. Послідовні курси флеботомії для попередження надмірного накопичення заліза рекомендуються кожні 3-4 місяці для чоловіків та щорічно або двічі на рік для жінок. Якщо ж рівень заліза значно збільшений, варто проводити біопсію печінки для виключення цирозу печінки.
Який прогноз?
Без лікування – прогноз несприятливий. Середня тривалість життя хворих після встановлення діагнозу та відсутності лікування не перевищує 4-5 років.
Чи можна попередити це захворювання?
Так. Для цього варто вчасно звернутися до лікаря-генетика, який проаналізує родовід, симптоми та призначить необхідні обстеження.
Чи можливо діагностувати це захворювання пренатально?
Так, технічно можливо при ідентифікованих мутаціях в обох батьків.
Переглянуто редакційною колегією I.B.I.S.: 31/05/2005
Дивіться також:
- Гемохроматоз (інформація для спеціалістів)
Гемохроматоз
(Hemochromatosis)
О.О. Трофімова
Лікар-генетик,
Донецького регіонального центру охорони материнства та дитинства
Визначення:
Гемохромaтоз (пігментний цироз печінки, бронзовий діабет, синдром Труаз’є-Ано-Шоффара, сідерофілія) – спадкове хронічне захворювання, що характеризується порушенням обміну заліза, підвищеним його вмістом у сироватці крові та накопиченням у вигляді гемосидерину в тканинах і внутрішніх органах із розвитком у них фіброзу.
Частота:
Розповсюдженість гену спадкового гемохроматозу складає 0,03–0,07% при частоті гетерозиготного носійства в європейській популяції близько 10%. В США розповсюдженість гемохроматозу оцінюється в межах 1 : 200–500. Частота гетерозиготного носійства мутацій C282Y та H63D складає 5,4% та 13,5% відповідно. Хворіють переважно чоловіки (співвідношення чоловіків і жінок 20:1).
Етіологія та патогенез:
Причиною захворювання є дві мутації у гені НFE-C282Y і Н63D. Мутація С282У зумовлює важку клінічну картину, а генотип С282У/C282Y – більшу пенетрантність. Однак, у частини пацієнтів що мають такий генотип, захворювання не розвивається. Пацієнти з генотипами С282У/H63D і Н63D/H63D також мають великий ризик накопичення заліза, але клінічні прояви розвиваються менш ніж у 1%. Початок захворювання у багатьох випадках пов’язують з дією факторів зовнішнього середовища, таких як порушення харчування, вживання алкоголю чи інших гепатотоксичних речовин. Первинний (“ідіопатичний”) гемохроматоз відносять до ферментопатій та розглядають як вроджене захворювання, при якому у тонкій кишці людини всмоктується значно більше заліза, ніж в нормі, і воно надлишково депонується в тканинах – в печінці, підшлунковій залозі, серцевих м’язах, шкірі, як правило, у вигляді нерозчинного гемосидерину. Виникає вторинна запально-склеротична реакція тканин уражених органів. У гладких м’язах також надлишково відкладається ліпофусцин, в епідермісі – меланін. Вторинний гемохроматоз виникає при надлишковому надходженні в організм заліза (тривалому лікуванні препаратами заліза, при повторних частих гемотрансфузіях).
Основні діагностичні критерії:
- Цукровий діабет;
- Цироз печінки;
- Кардіоміопатія;
- Темна (бронзова) пігментація відкритих ділянок шкіри;
- Гіпогонадізм;
- Рак печінки;
- Підвищена концентрація сироваткового заліза;
- Гіперферремія;
- Гіперглікемія;
- Глюкозурія.
Клініка:
У дитячому віці гемохроматоз проявляється нечасто, при цьому спостерігається первинний інфантилізм, біль в ділянці печінки, в юнацькому віці формується вторинна атрофія гонад. У зрілому віці, після 40 років, гемохроматоз клінічно проявляється симптомами цукрового діабету (60-80%), в 70% випадків діабет інсулінозалежний. До інших можливих ендокринних порушень відноситься дефіцит гормонів гіпофізу (гонадотропних, АКТГ, ТТГ), що клінічно проявляється генералізованою слабкістю (45%), гіпогонадизмом, тестикулярною атрофією та зниженням лібідо (15%). Постійний симптом гемохроматозу – гіпертрофічний цироз печінки, колір шкіри – від металево-сірого до бронзового (90%). Характерні скарги на болі різної локалізації (30%), головним чином, переважно печінки. Ураження серця виявляється тільки на ЕКГ (низький вольтаж, сплощення або інверсія зубця Т, часткова блокада).
Підвищена концентрація сироваткового заліза (до 50-70 мкмоль/л), насиченість залізом трансферина сягає 90% (при нормі 30%). Гіперферремія виявляється ще до того, як виникає гіперпігментація шкіри і збільшення печінки. Дослідження забарвленних блакитним нітропрусідом гістологічних препаратів, виготовлених з біоптатів печінки хворого, дозволяє виявити велику кількість внутрішньоклітинного заліза. Також документується підвищене виділення заліза з сечею після ін’єкції дефероксаміну. Біохімічні зміни, характерні для цирозу печінки, з’являються пізніше у поєднанні з гіперпігментацією та збільшенням печінки. Виявляється гіперглікемія і глюкозурія.
Перебіг захворювання постійно прогресуючий.
Ускладнення:
Печінкова та діабетична коми, асцит, серцева недостатність, аритмія, гостра кровотеча із варикозно-розширених вен стравоходу та шлунку.
Диференційний діагноз:
- Інші види гемохроматозів (ювенільний з аутосомно-рецесивним успадкуванням (2 тип, ОМІМ 602390), HFE-3 спадковий гемохроматоз, (його називають 3 типом спадкового гемохроматозу, OMIM 604250), тип 4 спадкового гемохроматозу (аутосомно-домінантний, ОМІМ 606069), що спричинений мутаціями у гені SLC40A1.
- Вторинний гемохроматоз (гемотрансфузійний), підвищення вмісту заліза в їжі.
Тип успадкування:
Аутосомно-домінантний. Ген локалізований на короткому плечі хромосоми 6, сегмент 21.3.
Вік маніфестації:
Інколи зустрічаються ювенільні форми, але найчастіше захворювання клінічно маніфестує у зрілому віці (після 40 років).
Лікування:
- Дієта: У дієті слід уникати вживання лікарських засобів, що містять залізо, мінеральних добавок, надлишку вітаміну С, сирих морських продуктів. Для тих, хто має проблеми з печінкою, слід не вживати алкоголю. Рекомендується харчування, збагачене білком, препарати, які зв’язують залізо і сприяють його виведенню: дефероксамін (по 10мл 10%-го розчину в/м або в/в), Б-десфераль з розрахунку 30-50 мл на кг маси тіла на добу.
- Терапевтична флеботомія – простий, недорогий, безпечний та достатньо ефективний метод лікування, що має на меті видалення надлишку заліза шляхом періодичної венепункції до досягнення рівня концентрації сироваткового ферритину 50 нг/мл і нижче. При досягненні цих значень, слід контролювати рівень ферритину кожні 3-4 місяці. Послідовні курси флеботомії для попередження надмірного накопичення заліза рекомендуються кожні 3-4 місяці для чоловіків та щорічно або двічі на рік для жінок. Для осіб, що є C282Y гомозиготними, з концентрацією ферритину в сироватці більше ніж 1000 нг/мл варто проводити біопсію печінки для виключення цирозу печінки.
Прогноз:
Прогноз без лікування несприятливий. Середня тривалість життя хворих після встановлення діагнозу та відсутності лікування не перевищує 4-5 років.
Профілактика:
У випадках, коли обидва HFE аллелі можуть бути ідентифіковані у пробанда, можливо проведення молекулярно-генетичного дослідження для виявлення гетерозиготного носійства серед родичів, наприклад сибсів.
У пацієнтів, яким не було проведено молекулярно-генетичний аналіз, і які є облігатними гетерозиготами, рекомендовано визначення насичення залізом трансферрину, враховуючи факт, що вони можуть бути компаунд-гетерозиготами.
Популяційний скринінг:
Висока частота гетерозиготного носійства гену гемохроматозу, відсутність патогномонічних ознак на початку хвороби, низька вартість діагностичних процедур, лікування та його ефективність при ранньому початку, в порівнянні з високою вартістю та низькою ефективністю діагностики та лікування на пізніх етапах захворювання, роблять доречним проведення популяційного скринінгу. Однак, з іншого боку пенетрантність генотипу низька, і, крім того, не можна передбачити перебіг захворювання у кожного конкретного хворого. Цим фактом обумовлено відсутність єдиних рекомендованих підходів щодо проведення скринінгу на популяційному рівні. Більш ефективним можна вважати скринінг у родинах високого ризику.
Пренатальна діагностика:
Пренатальна діагностика технічно можлива, якщо ідентифіковані мутації в обох батьків.
Література:
- Окороков А.Н. Диагностика болезней внутренних органов. Практ. руководство.- В 4 т.- Т. 1. – М.: Медицинская литература, 1999.- 560 с.
- Adams PC.: Interfamilial variation in hereditary hemochromatosis. Digest Dis Sci 1992;37:361-363.
- Bodmer JG, Parham P, Albert ED, Marsh SGE. Putting a hold on ‘HLA-H.’ (Letter) Nature Genet. 1997;15:234-235.
- Mura C, Nousbaum JB, et al. Phenotype-genotype correlation in haemochromatosis subjects. Hum Genet 1997;101:271-276.
- Nielsen JE, Jensen LN, Krabbe K. Hereditary haemochromatosis: a case of iron accumulation in the basal ganglia associated with a parkinsonian syndrome. J Neurol Neurosurg Psychiatry 1995;59:318-21.
- Worwood M, Darke C, Trenchard P. Hereditary haemochromatosis and blood donation. (Letter) Brit Med J 1991;302:593.
- Zappone E, Dugast I, Papadopoulos P. Polymorphism in a ferritin H gene from chromosome 6p. Hum Genet 1991;86:557-561.
Переглянуто редакційною колегією I.B.I.S.: 26/05/2005
Дивіться також:
- Гемохроматоз (інформація для батьків)
Гемофілія
(Hemophilia)
О.О. Михасюк
Інформаційний спеціаліст Рівненського ОМНІ-центру
Опис:
Гемофілія – це важке генетичне захворювання, яке характеризується порушенням згортання крові внаслідок дефіциту білків – факторів згортання крові. Тому при незначних травмах або навіть внаслідок м’язевого напруження під час рухів тіла, може виникнути сильна тривала кровотеча. Незважаючи на те, що гемофілію можна контролювати за допомогою відповідних дій, цей стан є пожиттєвим, починаючи з моменту народження дитини, і тому накладає певні обмеження на спосіб життя та поведінку хворого. Носіями спадкової ознаки хвороби є виключно жінки, але страждають на неї переважно чоловіки. Частота виникнення гемофілії – 1 випадок на 10000 новонароджених.
Існує 3 типи гемофілії. Найпоширенішим типом є гемофілія А (так звана класична гемофілія, або недостатність білкового фактора VIII), яка спостерігається у 80% усіх випадків. В 15% випадках гемофілії спостерігається тип В (хвороба Кристмаса, або недостатність фактора ІХ). Гемофілії типів А та В схожі між собою. Важкість прояву обох типів залежить від кількості фактора системи згортання крові, що є недостатнім у хворої дитини; чим менше фактору згортання крові, тим важчий перебіг гемофілії. Третій тип гемофілії є найлегшим – гемофілія С (недостатність фактора ХІ) спостерігається лише в 5% усіх випадків.
Серйозність ускладнень гемофілії обумовлена, швидше, можливістю виникнення внутрішньої кровотечі, ніж тривалістю зовнішньої. При внутрішній кровотечі кров може зібратися в будь-якій частині тіла. Найчастіше кровотечі виникають у суглобах. Проте кровотеча можлива і в інших ділянках тіла – м’язах, шкірі, нирках, шлунково-кишковому тракті, черевній порожнині, головному та спинному мозку та в слизових оболонках. Якщо кровотечу вчасно не зупинити або не попередити випадки повторної кровотечі, то гемофілія може призвести до постійного порушення функції суглобів, або навіть до смерті внаслідок порушення функціонування життєвоважливих органів. В наш час кількість пошкоджень суглобів та смерті від гемофілії постійно знижується. Більшість дітей з гемофілією можуть розраховувати на тривале життя і, головне, нормальний його спосіб.
Причина:
Гемофілія – це генетичне порушення. Типи А і В майже завжди є спадковими. Характерною особливістю хвороби є зв’язок із статтю – вона передається лише по жіночій лінії з Х-хромосомою.
Якщо у чоловіка з гемофілією та жінки, яка не є носієм хвороби, є сини, то вони будуть цілком здоровими. Проте, всі їх доньки будуть носіями гемофілії. В дуже рідкісних випадках, коли у чоловіка з гемофілією та жінки, яка є носієм ознаки хвороби, є діти, то існує 50% вірогідність того, що кожна їх дочка захворіє на гемофілію і стільки ж відсотків того, що вона буде носієм хвороби. Вірогідність захворювання кожного з синів становить 50%. Отож, решта 50% залишає надію на те, що вони будуть здоровими.
В однієї третини або однієї четвертої усіх важких випадків сімейний спадковий характер не простежується. Можливо, в більшості випадків причиною захворювання є спонтанна мутація, оскільки неможливо було підтвердити, що мати або бабуся по материнській лінії були носіями гемофілії.
Недостатність фактора ХІ є спадковою ознакою, але вона не переноситься статевими хромосомами, тому хворіти можуть представники обох статей. Носії генів гемофілії самі не хворіють.
Ознаки і симптоми:
У дітей, які страждають на гемофілію, кровотеча не є швидшою, ніж у здорових дітей, але триває значно довше. Важкість кровотечі залежить від ступеня недостатності фактора: слабкої, помірної або важкої. У дітей з легкою формою гемофілії сильна кровотеча спостерігається лише при великих травмах або оперативному втручанні. При важкій гемофілії кровотеча може бути тривалою навіть при незначних травмах. Найчастіше кровотечі є внутрішніми – підшкірними, внутрішньом’язевими або в порожнини суглобів. Незначний удар в ділянку гомілки хворої дитини може призвести до появи великих крововиливів. Однією з найпоширеніших особливостей важкої форми гемофілії є скупчення крові в суглобах. Воно може виникати як внаслідок травм, так і само по собі. При цьому дитина відчуває сильний біль, стає дратівливою, ушкоджений суглоб набрякає, рухи стають обмеженими. Спостереження показують, що часто невелика кількість крові з’являється в сечі, але це не є ознакою важкості захворювання. Під час хірургічних операцій або при видаленні зуба у дітей з гемофілією кровотечі є надзвичайно тривалими. Часто здається, що кровотеча вже зупинилась, але за кілька днів вона починається знову. Це відбувається внаслідок руйнування того згустку крові, що вже утворився – рана знову відкривається і кровоточить. Проте, сильної кровотечі з невеликих порізів або подряпин в хворих на гемофілію не буває. Загрозу становить саме тенденція до внутрішніх крововиливів, запущені випадки яких призводять до інвалідності або смерті.
Ознаками травми голови або хребта можуть бути крововиливи, “безпричинні” болі голови, що не піддаються медикаментозному лікуванню, напади нудоти, загальмованість, порушення орієнтації, підвищена сонливість, відсутність сили для рухів кінцівками. Про черевну кровотечу можуть свідчити блідість шкіри, слабкість, підвищена пітливість.
У дітей з дефіцитом фактору ХІ сильна кровотеча, крововиливи та утворення гематом в суглобах спостерігаються рідко. Однак, після оперативного втручання кровотеча може бути дуже сильною.
Діагностика:
Якщо у новонародженої дитини чоловічої статі обрізається крайня плоть, то гемофілія може діагностуватися лікарем, що проводив цю процедуру. В решті випадків гемофілія може бути запідозреною якщо у дитини виникають незвичайно великі і темні синці. Стоматолог може виявити гемофілію після того, як видалить зуб у дитини. Важкі випадки гемофілії майже завжди діагностуються до 3-4 років. Діагноз підтверджується аналізом крові, в якому визначається кількість фактору системи згортання крові. У людини з важкою формою гемофілії кількість цього фактору становить менше 1% від норми. В той час, як при легкій формі фактор згортання крові присутній на 5-40%.
Лікуючий лікар повинен вивчити сімейний анамнез такого хворого. У носіїв гемофілії часто є брати, дядьки або бабуся (по материнській лінії), які страждають на цю хворобу; жінок, які мають в родинному анамнезі гемофілію, слід ретельно обстежити і з’ясувати, чи не є вони носіями хвороби. Це можна визначити з 95% точністю шляхом спеціального аналізу крові. Такі дослідження робляться в більшості лікарень.
Ускладнення:
Оскільки травма може призвести до тривалої кровотечі та ушкодження суглоба, фізична активність дітей з гемофілією має бути обмеженою. Вони не можуть займатися контактними видами спорту, однак фізичні вправи, особливо плавання, є надзвичайно корисними. Вони зміцнюють суглоби але не збільшують навантаження на судини. Через ризик кровотечі в суглобах ці діти не зможуть бігати на великі відстані або робити інші вправи, пов’язані з підвищенням артеріального тиску.
В рідкісних випадках може виникати мозкова кровотеча – це є надзвичайним станом. Пацієнти з гемофілією можуть отримувати кров від багатьох донорів. Тому під час переливання вони ризикують отримати алергічні ускладнення, заразитися гепатитом або іншими інфекціями, що передаються з кров’ю. Проте, слід зазначити, що важкі форми гепатиту рідко уражають людей з гемофілією.
Лікування:
Вилікувати гемофілію неможливо. Проте в останні роки методи лікування та профілактики гемофілії зазнали значних змін. Початок лікування на ранній стадії захворювання може значно знизити втрату працездатності.
В даний час в більшості випадків лікування можна проводити вдома у вигляді звичайної амбулаторної допомоги. Невеликі травми, включаючи синці та носові кровотечі, можна лікувати за допомогою натискання та холодних компресів. Якщо кровотеча не зупиняється, то один з батьків або хтось з родичів має зробити ін’єкцію того фактора згортання, якого недостає. Такий вид лікування є швидким та ефективним.
Раніше діти і підлітки, хворі на гемофілію, багато часу проводили у шпиталях. Цього потребували спеціальні процедури лікування та реабілітації. Зазвичай вони включали пов’язки з льодом, бандажі та ліжковий режим. Крім того, проводилися переливання крові та плазми. Але ці процедури не є достатньо ефективними. Для профілактики подальшого ушкодження кінцівок проводилась їх повна іммобілізація. Тому такі хворі могли протягом кількох тижнів знаходитись у гіпсі чи корсетах, і пересуватися за допомогою милиць. Сучасні аспекти лікування гемофілії спрямовані на якнайшвидше припинення кровотечі для запобігання пошкоджень суглобів.
До та після оперативного втручання дитині слід призначити введення великих доз концентрованого фактору крові. Після видалення зуба, дитину з гемофілією варто госпіталізувати для контролю за процесом загоєння ранки. Також рекомендована ретельна гігієна зубів та регулярний огляд порожнини рота.
Приблизно 10% пацієнтів з гемофілією А – типу мають інгібітори або антитіла до фактору згортання крові, якого бракує їхньому організму. Коли фактор системи згортання вводиться ззовні, він активується антитілами. Пацієнтами, що приймають такі інгібітори, може бути використаний цілий ряд форм лікування, але їх ефективність є обмеженою. Такі пацієнти зазвичай страждають на хронічні ушкодження або захворювання суглобів, спричинені кровотечами.
Профілактика:
Жінку, в сімейному анамнезі якої відмічена гемофілія, слід обстежити і з’ясувати, чи не є вона носієм цього спадкового порушення. У випадку підтвердження цього факту вона має проконсультуватися в лікаря – генетика стосовно вірогідності передачі хвороби своїм дітям. Жінки мають усвідомлювати загрозу для їх синів захворіти на гемофілію, а для доньок бути її носіями.
Для визначення гемофілії в пренатальний період треба взяти аналіз крові плода за допомогою фетоскопу.
Чоловікам, які хворіють на гемофілію, слід уникати застосування аспірину та інших медикаментозних засобів, що впливають на згортання крові. Відносно ж прийому жарознижуючих ліків, знеболюючих та протизапальних засобів, пацієнту треба консультуватися з лікарем.
Сучасне всебічне лікування гемофілії зосереджено на припиненні кровотеч ще на ранній стадії та попередження ускладнень гемофілії.
Переглянуто редакційною колегією I.B.I.S.: 11/06/2002
Гемігіпертрофія (гемігіперплазія)
(Hemihypertrophy, Hemihyperplasia)
В.М. Письменна
Лікар-педіатр
Рівненська міська дитяча лікарня
Включення:
Гемігіперплазія, гемігіперплазія ізольована, гемі-3 синдром.
Визначення:
Hemi – пів та гіпертрофія – збільшення розмірів.
Клінічна картина:
Основний прояв гемігіпертрофії – збільшення розмірів половини тіла, асиметрія тіла. Асиметрія зазвичай присутня від народження і може посилюватись з віком, особливо в пубертаті. Гемігіпертрофія відрізняється за ступенем ураження: від збільшення всієї половини тіла (тотальна гемігіпертрофія) до збільшення частини тіла (часткова або сегментарна гемігіпертрофія), іноді збільшуються несуміжні ділянки тіла (перехресна гемігіпертрофія).
Відмічено підвищену масу тіла у дітей при народженні (біля 3800 г). Відмічаються значні вегетативно-трофічні порушення на уражених ділянках. Це проявляється асиметрією потовиділення з гіпергідрозом на стороні гіпертрофії і асиметрією місцевого дермографізму. Порушення чутливості відсутні. Відмічається асиметрія температури шкіри, яка на 1,5-2°С вища на боці гемігіпертрофії. Кістки на стороні ураження збільшені, спостерігається випередження кісткового віку.
Зустрічаються також пухлини (нейробластома, феохромацитоми тощо). Може спостерігатись ураження всіх тканин: кісток, м’язів, підшкірної клітковини, шкіри: гіпертрихоз на гіпертрофованих кінцівках, на стороні ураження відмічається раннє прорізування та випадання молочних зубів. Класична гемігіпертрофія частіше спостерігається справа і з більшою частотою у чоловіків.
Поєднані аномалії:
Приблизно в 20-30% випадків зустрічаються пігментні невуси, гемангіоми, розумова відсталість, аномалії сечостатевої системи. З боку нервової системи можливі гемігіперестезія, геміарефлексія. Спостерігаються сколіоз, гірсутизм. Черепно-лицьові аномалії включають мікроцефалію, макроцефалію, гіпертрофію тканин орбіти. Спостерігаються глаукома, катаракта, колобома, гетерохромія райдужки, а також вісцеромегалія, гемангіоми шлунково-кишкового тракту, сечовивідної системи, додаткові великі судини. У 5,9% випадків гемігіпертрофії зустрічаються пухлини. Хворі на гемігіпертрофію схильні до розвитку пухлин нирок (пухлина Вільмса), кори наднирників (карцинома кори наднирників) і печінки (гепатобластома). Можуть спостерігатися розумова відсталість і судомний синдром, мієломенінгоцеле.
Діагностика:
Специфічних змін лабораторних показників не виявлено. При рентгенографії характерне випередження кісткового віку гіпертрофованої кінцівки. Пацієнтам з ізольованою несиндромною гіперплазією необхідно проводити ультразвукове дослідження з метою виявлення пухлин, особливо пухлини Вільмса, кожні 6 місяців в перші 4 роки життя і, якщо можливо, до досягнення 7-річного віку. Хромосомний аналіз у деяких випадках дозволяє виявляти різні типи мозаїцизму.
Диференційний діагноз:
- Симптоми гемігіпертрофії складають основну клінічну картину рідкісних варіантів ангіоматозних форм факоматозів, наприклад, синдрому Кліппеля-Треноне-Вебера (гіпертрофічної геміангіектазії).
- Нейрофіброматоз.
- Синдром лінійного бородавчатого епідермального невуса.
- Вроджена геміатрофія.
- Синдром Рассела-Сільвера.
- Синдром Беквіта-Відемана.
- Синдром Протея.
- Синдром НІРО (гемігіперплазія, кишкові мембрани, преаурикулярні додатки, помутніння рогівки).
Асиметрія може бути також пов’язана з артеріовенозною аневризмою, вродженою лімфедемою, синдромом Мак-К’юна-Олбрайта, множинними екзостозами, синдромами Маффучі, Ольєра, Лангера-Гідіона, синдромом гіперплазії/ліпоматозу.
Етіологія і патогенез:
Повністю не зрозумілі. Гемігіпертрофія звичайно буває вродженою і являє собою комбіновану ваду екто-мезодермального походження. Нерідко вона пов’язана з порушенням лімфообігу і кровообігу в уражених ділянках внаслідок аномалії розвитку судин. В її походженні має значення також ураження симпатичної нервової системи. Різноманітні випадки хромосомного мозаїцизму було знайдено, включно диплоїдний/триплоїдний мозаїцизм і мозаїцизм по трисомії 18.
Тип успадкування:
Аутосомно-рецесивний або мультифакторіальний.
Популяційна частота:
За даними літератури частота гемігіперплазії оцінена як 1:86000 живонароджених.
Співвідношення статей:
Помічено, що жінки частіше страждають на гемігіперплазію (2:1).
Прогноз:
Захворювання проявляється від народження і може посилюватись з віком, особливо в пубертаті.
Номер з каталогу МІМ:
235000 Hemihyperplasia, Isolated; IH.
Література:
- Наследственные синдромы и медико-генетическое консультирование /С.И. Козлова, Е.С. Семенова, И.С. Демикова, О.Е. Блинникова.- М.: Практика, 1996.- С. 65.
- Gorlin RJ, Cohen MM, Hennekam RCM. Syndromes of the Head and Neck. 4th edition. Oxford University Press 2001:405-408.
- Warkany J. Congenital Malformations. Notes and Comments. Year Book Publisher, Chicago 1981:163-167.
Переглянуто редакційною колегією I.B.I.S.: 04/05/2005
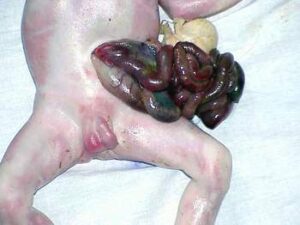
Гастрошизис та особливості лікувальної тактики
(Gastroschisis)
Н.Г. Тандура
Лікар-неонатолог
Волинського обласного дитячого територіального медичного об’єднання
Визначення:
Гастрошизис – вроджений дефект передньої черевної стінки, через який випадають назовні органи шлунково-кишкового тракту, рідше сечовий міхур і матка (у дівчаток).
Мінімальні діагностичні критерії:
- Дефект передньої черевної стінки невеликих розмірів, розміщений справа від нормально прикріпленої пуповини.
- Евентровані петлі кишківника змінені – гіперемовані, розширені, покриті фібрином, не мають захисної оболонки.
- Печінка і селезінка завжди залишаються в черевній порожнині.
- Черевна порожнина малих розмірів.
Частота: 0,94 : 10000 новонароджених.
Етіологія:
Виникає в період раннього ембріогенезу між 5 і 8 тижнями гестації в результаті дії одного чи більше генів та факторів навколишнього середовища (мультифакторіальне успадкування). Можливе аутосомно-рецесивне успадкування. Ймовірність повторення у сібсів мінімальна. Гастрошизис рідко зустрічається у плодів вагітних старше 30 років. У 74% випадків буває при першій вагітності.
Патогенез:
Подвоєння омфалобрижової артерії виникає в ранньому ембріогенезі у вигляді маленьких судин із дорзальної аорти. Ліва омфалобрижова артерія регресує. Проксимальна частина правої омфалобрижової артерії стає верхньою брижовою артерією. Дистальна частина омфалобрижової артерії проходить через умбілікальне кільце в жовтковий міхур і розміщується справа від плоду. При порушенні розвитку дистальної частини омфалобрижової артерії виникає інфаркт і некроз основи пуповини і пролабування кишки через цю інфарктну ділянку з заживленням по краям дефекта до моменту народження. Перерва омфалобрижової артерії більш проксимально (верхня брижова артерія) веде не тільки до гастрошизиса, але і до атрезії або стенозу кишківника, що за даними різних авторів складає 10-40%. Гастрошизис супроводжується не тільки анатомічним, а і біохімічним дефектом. За рахунок зниження ферменту аденозинтрифосфатази в гладких м’язових волокнах, ацетилхолінестерази в нервових гангліях, зниження NO-синтетази, затримки розвитку ворсин і субмукози виникає функціональна неповноцінність кишківника, яка проявляється гіпоперистальтикою і мальабсорбцією.
Клініка:
Діти з гастрошизисом мають малу вагу при народженні, в 77% – ЗВУР, 55% – недоношені діти. Яким би великим не був об’єм евентрованих органів, дефект передньої черевної стінки має невеликі розміри – 3-4 см. Евентровані петлі кишківника знаходяться в стані запалення – гіперемовані, розширені, а з початком функціонування нирок плода (термін гестації 30 тижнів) і змінами в складі амніотичної рідини покриті фібринозним нальотом. Гастрошизис супроводжується перитонітом, внутрішньоутробно-асептичним, після народження-бактеріальним. При гастрошизисі дуже рідко буває супутня вроджена патологія інших органів і систем і досить часто вроджені вади розвитку кишківника, а саме: вроджений короткий кишківник, відсутність диференціації на тонкий і товстий кишківник, вади ротації і фіксації, атрезії і інші. У всіх дітей з гастрошизисом має місце аномальне прикріплення брижі тонкого кишківника.
Співвідношення між статями: Ч1 : Ж1.
Вік прояву: при народженні.
Генне картування і зчіплення генів: невідомо.
Пренатальна діагностика:
Під час ультразвукового дослідження черевну порожнину візуалізують з 10-14 тижня розвитку плоду. При дослідженні материнської сироватки на альфа-фетопротеїн рівень останнього у вагітних плодом з гастрошизисом завжди підвищений. Реакція неспецифічна, діагноз гастрошизису підтверджується при УЗД. Виявлення гастрошизису пренатально дозволяє розробити подальшу тактику ведення вагітності, пологів та лікування дитини. Є дані, що хірургічне лікування гастрошизису спрощується, коли при УЗД діагноз ставиться до моменту ущільнення кишкової стінки і проводиться передчасний кесарів розтин.
Ускладнення:
Перитоніт, синдром мальабсорбції, затримка нормальної перистальтики, яка відновлюється через 4 тижні після первинного закриття дефекту.
Лікування:
Хірургічне, формування вентральної кили.
Тактика ведення дітей з гастрошизисом
- Для профілактики больового шоку після народження робиться обезболення: новокаїнова блокада введенням 0,5% розчину новокаїну 2,5-3,5 мл в брижу тонкого кишківника і промедол 1-2 мг внутрішньом’язево.
- Для зменшення випаровування і рухомості органи, що випали, прикривають стерильною салфеткою, просоченою теплим розчином антисептика, і поміщають в стерильний поліетиленовий пакет, який фіксують стерильною пелюшкою.
- Проводять зондування шлунку для декомпресії і катетеризацію сечового міхура для контролю за діурезом.
- Дитину поміщають в кувез, температура 32-34°.
- Антибактеріальна терапія, І курс-емпірична схема: цефалоспорини II покоління + аміноглікозиди + метрогіл або цефалоспорини III покоління + метрогіл, в подальшому з врахуванням антибіотикограми (мікробний моніторинг 2 рази на тиждень). Селективна деконтамінація кишківника в до- і післяопераційний період (призначенням per os гентаміцину, фузидину, невіграмону і інших).
- Інфузійна терапія (10% глюкоза, свіжозаморожена плазма, альбумін) в об’ємі в першу добу 50-60 мл/кг, в найближчий післяопераційний період об’єм рідини із розрахунку половини добової фізіологічної потреби. Парентеральне харчування призначається з 2 доби після операції.
- Інфузійна терапія (10% глюкоза, свіжозаморожена плазма, альбумін) в об’ємі в першу добу 50-60 мл/кг, в найближчий післяопераційний період об’єм рідини із розрахунку половини добової фізіологічної потреби. Парентеральне харчування призначається з 2 доби після операції.
- Примінення допаміна як до операції, так і після операції в дозі 1,5-2,5 мкг/кг/хв (при необхідності дозу можна підвищити).
- У дітей з вираженою клінікою перитоніту – контрікал 2-4 тис. од/кг.
- Основні критерії готовності дитини до операції: стабільна центральна і периферична гемодинаміка, діурез не менше 1 мл/кг/год, усунення гемоконцентрації по показникам гемоглобіну і гематокриту.
- Перед операцією промивання шлунка та кишківника ізотонічним розчином NaCl з трипсином, панкреатином, ацетилцистеїном.
- Премедикація і переведення на штучну вентиляцію легень (до операції ШВЛ в режимі нормовентиляція, після операції ШВЛ в режимі нормо-при потребі гіпервентиляція, і з 4-6 доби допоміжна штучна вентиляція легень до моменту купування процесу в черевній порожнині).
- Для зменшення дози наркотичних аналгетиків, як альтернатива комбінованій загальній анестезії (фентаніл 50 мкг/кг/год + ГОМК) рекомендована сакральна епідуральна анестезія (бупівакаїн 0,25% 1 мл/кг) в поєднанні з загальною анестезією (ГОМК 100 мг/кг та фентаніл 5-10 мкг/кг/год). Після операції адекватна аналгезія з використанням промедолу протягом 1-2 діб і разове застосування каудально-епідуральної блокади з використанням бупівакаїну.
- Для покращення роботи кишківника призначається церукал, гіпертонічні клізми з АЦЦ, трипсином, панкреатином, per os – сульфат магнію, вазелінове, касторове масло, місцево з 2-3 дня – напівспиртові компреси на живіт.
- За відсутністю застійного вмісту в шлунку проводять водне ентеральне навантаження по 5 мл через 2 год, через 1 добу вводять молочні суміші з поступовим збільшенням разового об’єму годування на 5 мл. З розширенням ентерального харчування зменшується об’єм парентерального харчування і повний перехід на ентеральне харчування здійснюється протягом 12-20 діб після операції.
Прогноз:
Смертність немовлят, оперованих з приводу гастрошизиса, в останні роки становить 30%. У дітей, оперованих з приводу гастрошизиса, в подальшому відмічається сповільнений фізичний розвиток до 5 років. В подальшому вони не відстають від своїх ровесників.
Номер з каталогу МІМ:
230750 Gastroschisis
Література:
- Baird PA, MacDonald EC. An epidemiologic study of congenital malformations of the anterior abdominal wall in more than half a million consecutive live births. Am J Hum Genet. 1981 May;33(3):470-8.
- Bealer JF, Graf J, Bruch SW, Adzick NS, Harrison MR. Gastroschisis increases small bowel nitric oxide synthase activity. J Pediatr Surg. 1996 Aug;31(8):1043-6.
- Coupland GA. Gastroschisis and colonic obstruction. Med J Aust. 1969 Feb 15;1(7):344-5.
- Molenaar JC, Tibboel D. Gastroschisis and omphalocele. World J Surg. 1993 May-Jun;17(3):337-41.
Переглянуто редакційною колегією I.B.I.S.: 08/09/2003
Дивіться також:
- Гастрошизис (інформація № 2)
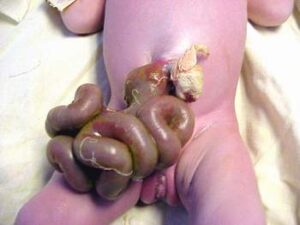
Гастрошизис
(Gastroschisis)
О.П. Завгородня
Лікар-генетик,
Зав. Херсонською обласною медико-генетичною консультацією
Визначення:
Біляпупковий дефект передньої черевної стінки, зазвичай справа, з випинанням внутрішньочеревного вмісту безпосередньо в амніотичну порожнину, без захисної мембрани.
Основні діагностичні критерії:
- невеликий дефект черевної стінки;
- маленька черевна порожнина;
- пуповина звично прикріплена до черевної стінки зліва від дефекту;
- вип’ячені органи зазвичай складаються з потовщеного тонкого кишківника;
- відсутність покривної оболонки.
Клінічна картина:
- низька вага малюків при народженні;
- маленька черевна порожнина;
- невеликий дефект черевної стінки без залишку покривної оболонки;
- стінка вип’яченого тонкого кишківника потовщена, заплутана, набрякла і хронічно запалена.
Етіологія:
Пропонуються дві теорії:
- Ранній внутрішньоутробний розрив омфалоцеле з повним наступним розсмоктуванням покривної мембрани.
- Внутрішньоутробне судинне порушення з втягуванням омфалобрижової артерії.
Патогенез:
Вважається, що гастрошизис формується між п’ятим та десятим тижнями вагітності. Причиною його є недостатній розвиток передньої черевної стінки з наступним її розривом по мірі зростання абдомінального тиску.
Гастрошизис асоціюється з анатомічними та біологічними змінами у вип’яченому кишківнику. Такі зміни включають укорочення, набряк, заворот кишки та інфаркт середньої кишки. Укорочення пов’язане з хронічним внутрішньоутробним впливом амніотичної рідини на кишківник з наступними серозними змінами, які призводять до фіброзу та вкорочення кишківника. Заворот тонкої кишки та інфаркт середньої кишки можуть бути пов’язані з відсутністю фіксації кишківника і надмірною вагою вип’яченого кишківника.
Співвідношення між статями: Ч1 : Ж1.
Частота виникнення гастрошизису:
1 : 6000 живонароджених. Частіше вада зустрічається у плодів молодих вагітних віком до 25 років.
Ймовірність повторення у сібсів: мінімальна.
Вік прояву:
При народженні. Внутрішньоутробно можливе виявлення при ультрасонографії, починаючи з другого триместру вагітності.
Картування зчіплення генів: невідоме.
Профілактика:
Невідома. Рекомендована генетична консультація.
Лікування:
Хірургічне закриття дефекту.
Прогноз:
При важких формах гастрошизису – несприятливий. До факторів, які впливають на прогноз, відносяться ступінь недоношеності, наявність або відсутність асоційованих аномалій та ступінь розширення кишківника і потовщення стінки, що може компенсувати відновлення функції. При своєчасному хірургічному лікуванні виживання 90%.
Виявлення носія: невідоме.
Номер з каталогу МІМ:
230750 Gastroschisis.
Література:
- Calzolari, Biahchi F, Dolk H, Milan M. EUROCAT Working Group: Omphalocele and gastroschisis in Europe: a survey of 3 million birth 1980 – 1990. Am J Med Genet 1995;58:187-194.
- Lowry RB, Baird PA. Familial omphalocele and gastroschisis. Letter Am J Hum Genet 1982;34:517-518.
- Salinas CF, Bartoshevsky L, Othersen HB, Leape L, Feingold M, Jorgenson RJ. Familial occurrence of gastroschisis. Am J Dis Child. 1979;133:514-517.
Переглянуто редакційною колегією I.B.I.S.: 08/09/2003
Дивіться також:
Галактоземія
(Galactosemia)
О. Ходан
Лікар-неонатолог
Рівненського пологового будинку №1
Визначення:
Галактоземія – це спадково зумовлена аномалія обміну речовин, яка призводить до накопичення в організмі галактози. При галактоземії порушений перехід галактози в глюкозу внаслідок генетичного дефекту ферменту галактозо-І-фосфатуридил-транферази (Г-І-ФУТ).
Основні діагностичні критерії:
- Прогресуючий перебіг
- Гепатомегалія
- Жовтяниця
- Катаракта
- Розумова відсталість
- Дефіцит галактозо-І-фосфат-уриділтрансферази
Клінічна картина:
Симптоми захворювання з’являються у новонароджених після прийому молока. У важко хворих на 2-3 день життя спостерігається жовтяниця (78%), гіпербілірубінемія непряма; на 5-6 день життя виявляють гепатомегалію (90%), зрідка – спленомегалію; блювота (37%), анорексія і велика втрата маси тіла (54%), діарея (7%), здуття живота (20%), летаргія або приступи гіпоглікемії. В цей період катаракта ще не розвивається, але в кришталику можна вже побачити помутніння. Дуже часто у таких дітей розвивається сепсис, викликаний грам негативною мікрофлорою, найчастіше – кишковою паличкою. Цей варіант протікання характерний для дітей з нульовою активністю галоктозо-І-фосфатуридилтрансферази. При інших варіантах, коли активність ферменту визначається до 10% від норми або при дефіциті галактокінази в період новонароджуваності, діти можуть виглядати здоровими. І лише на першому році життя розвивається катаракта, збільшення печінки з поступовим розвитком цирозу, але без розумової відсталості.
При іншому варіанті (Duarte) у гомозигот залишкова активність ферменту в еритроцитах становить близько 50% від норми. Змішані гетерозиготи по варіанту Duarte і класичній недостатності трансферази мають залишкову активність рівну приблизно 25%. У них знижена толерантність до навантаження галактозою, але клінічно вона не проявляється. Інші варіанти – Rennes, Indiana і Los Angeles – клінічно характеризуються не так чітко і проявляються мінімальною симптоматикою.
Лабораторна діагностика:
Лабораторні дослідження виявляють: гіпергалактоземію, галактозурію, протеїнурію, патологічну криву при навантаженні галактозою, зниження активності галактозо-І-фосфатуридилтрансферази в еритроцитах.
Етіологія:
Ген локалізований на 9р13. Хвороба має аутосомно-рецесивний тип успадкування з множинними алелями.
Частота галактоземії:
Частота серед живонароджених може коливатись 1 : 2000-60000.
Співвідношення статей: Ч1 : Ж1.
Патогенез:
Механізм розвитку галактоземії пов’язаний з аномальним синтезом двох ферментів, що призводить до їх функціонального дефіциту: галактокінази (каталізує початкове фосфорилювання галактози) або галактоз-І-фосфатуридилтранферази (відповідає за утворення з галактозо-І-фосфату глюкозо-І-фосфату). Накопичення в крові галактози або галактозо-І-фосфату визначає розвиток гепатотоксичності, розумової відсталості і катаракти (накопичення галактіолу).
Лікування:
Лікування полягає в вигодовуванні безлактозними сумішами. Необхідно повністю виключити будь-яке молоко, суміші на основі молока, так як всі вони містять лактозу. Рекомендовано суміші на соєвому, мигдальному молоці.
Прогноз:
Без лікування хворі помирають в перші місяці життя від інфекцій або печінкової недостатності. У тих, що вижили, розвивається ядерна катаракта і розумова відсталість. При ранньому призначенні дієти діти можуть розвиватись нормально.
Номер з каталогу МІМ:
230400 Galactosemia.
Література:
- Jones KL. Smith’s Recognizable Patterns of Human Malformation. Philadelphia: W.B. Saunders Company, 1997:680-686.
- Warkany J. Congenital Malformations: Notes and Comments. Chicago: Year Book Publisher, 1981:374-375.
- Козлова С.И., Демикова Н.С., Семанова Е., Блинникова О.Е. Наследственные синдромы и медико-генетическое консультирование.- М.: Практика,1996.- C. 61-62.
- Педиатрия /Под ред. Дж. Грефа.- М.: Практика, 1997.- C. 228-230.
Переглянуто редакційною колегією I.B.I.S.: 11/06/2002
Синдром “плаваючої гавані”
(Floating-Harbor Syndrome)
О.П. Семененко
Лікар-генетик
Черкаського обласного перинатального центру
Синоніми:
- Floating-Harbor syndrome.
Частота:
Описано близько 15 випадків.
Основні діагностичні критерії:
- Затримка росту.
- Бульбоподібний ніс.
- Затримка мовного розвитку.
Історична довідка:
Pelletier і Feingold описали першого пацієнта з цими порушеннями в 1973 р. Через рік Leisti доповів про дитину з майже подібними проявами і запропонував термін “Синдром плаваючої гавані” – змішана назва лікарень (Boston Floating and Harbor General), де були описані перші два пацієнти.
Клінічна характеристика:
Зріст:
- Зріст і вага новонароджених становлять близько 3 перцентиля. Виражена затримка постнатального росту. Затримка кісткового віку.
Обличчя та шия:
- Широкий бульбоподібний ніс з виступаючою перетинкою та широкими ніздрями.
- Короткий фільтр.
- Широкий рот з тонкими губами.
- Випуклі очі, які в старшому дитинстві здаються глибоко посадженими, відстовбурчені вуха.
- Коротка шия з низьким ростом волосся. Риси обличчя мають найбільш характерні прояви в дитячому віці.
Китиці рук:
- Клинодактилія п’ятих пальців.
- Брахідактилія.
- Широкі перші пальці.
- Гіпермобільнісь суглобів.
Розвиток:
- Виражена затримка мови.
- Порушення експресивної мови.
- Легка розумова відсталість.
- Нормальний моторний розвиток.
Поєднані симптоми:
- Трикутне лице.
- Гірсутизм.
- Довгі вії.
- Стеноз легеневої артерії.
- Аномалії ребер.
- Додатковий великий палець.
- Синдактилія.
- Конусоподібні епіфізи.
- Хвороба Пертеса.
- Целіакія.
- Схильність до закрепів.
Лікування: симптоматичне.
Профілактика: не розроблена.
Етіологія:
Невідома. Всі випадки спорадичні.
Номер з каталогу МІМ:
136140 Floating-Harbor Syndrome; FLHS.
Список літератури:
- Gorlin RJ, Cohen MM, Hennekam RCM. Syndromes of the Head and Neck. 4-th edition. Oxford University Press. 2001:1084.
- Houlston RS, Collins AL, Dennis NR, Temple IK. Further observations on the Floating-Harbor syndrome. Clin Dysmorph 1994;3:143-149.
- Jones KL. Smith’s Recognizable Patterns of Human Malformation. 5th ed. Philadelphia: W. B. Saunders Company 1997:136-137.
- Patton MA, Hurst J, Donnai D, McKeown CME, Cole T, Goodship J. Floating-Harbor syndrome. J Med Genet 1991;28:201-204.