Ірина Гогоша
Анемія Мінковського-Шоффара
(Spherocytosis Hereditary)
Лікар-неонатолог
Волинського обласного дитячого територіального медичного об’єднання
Визначення:
Генетичний дефект білка мембрани, утворення сфероцитів, посилений їх гемоліз в селезінці.
Частота:
Розповсюдженість спадкового сфероцитозу становить 2-3 на 10000 населення.
Етіологія та патогенез:
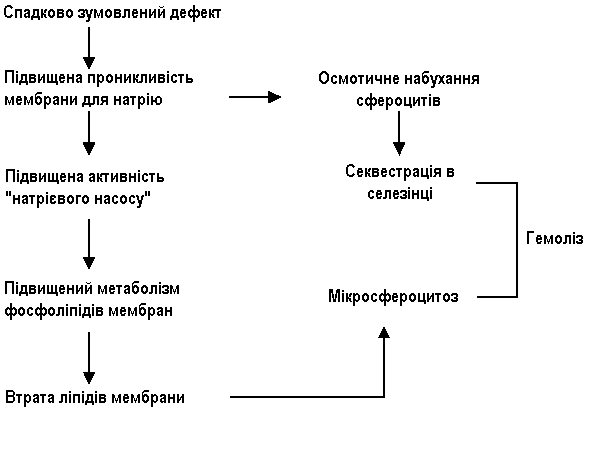
В основі захворювання лежить генетичний дефект білка мембрани еритроцита, що призводить до проникнення в еритроцит надлишку іонів натрію та підвищеному накопиченню в ньому води, внаслідок чого утворюються сферичні еритроцити (сфероцити).
Сфероцити, на відміну від нормальних еритроцитів, не мають здатності деформуватися у вузьких ділянках кровотоку, наприклад при переході в синуси селезінки. Це призводить до уповільнення просування еритроцитів в синусах селезінки, відщеплення частини поверхні еритроцита з утворенням мікросфероцитів та поступової їх загибелі. Зруйновані еритроцити поглинаються макрофагами селезінки. Постійний гемоліз еритроцитів в селезінці веде до гіперплазії клітин її пульпи та збільшення органа. В зв’язку з посиленим розпадом еритроцитів в сироватці підвищується вміст білірубіну. Білірубін надходить в кишківник та виводиться з організму з сечею та, головним чином, з випорожненнями у вигляді стеркобіліну. Добове виділення стеркобіліну при спадковому мікросфероцитозі перевищує норму в 10-20 разів.
Наслідком підвищеного виділення білірубіну в жовч є утворення пігментних каменів в жовчному міхурі та протоках.
 Основні діагностичні критерії:
Основні діагностичні критерії:
Нормохромна анемія, гемолітична жовтяниця, спленомегалія, наявність мікросфероцитозу, симптоми гемолітичної жовтяниці у членів сім’ї.
Клініка:
Клініка залежить від вираженості гемолізу. В більшості випадків перші ознаки виявляються в молодому або зрілому віці. У дітей хвороба виявляється часто при обстеженні з приводу захворювання їх родичів. Скарги поза загостренням можуть бути відсутні. В період загострення відмічаються слабке запаморочення голови, підвищення температури тіла.
Одним з основних клінічних симптомів є жовтяниця, яка довгий час може лишатися єдиною ознакою захворювання. Вираженість жовтяниці залежить з одного боку, від інтенсивності гемолізу, а з другого – від здатності печінки до кон’югації вільного білірубіну з глюкуроновою кислотою. В сечі білірубін не виявляється. Випорожнення інтенсивно забарвлені в темно-коричневий колір внаслідок підвищеного вмісту стеркобіліну.
Кардинальним симтомом спадкового мікросфероцитозу є збільшення селезінки. При тривалому гемолізі спостерігається значна спленомегалія, в зв’язку з чим хворі скаржаться на відчуття тягара в лівій підреберній ділянці.
Печінка при неускладненому захворюванні нормальних розмірів, але іноді у хворих, які довготривало страждають гемолітичною анемією, виявляється її збільшення.
Можуть спостерігатися:
- вторинні аномалії скелету – “баштовий череп”, широка спинка носа, високе піднебіння, вузька альвеолярна дуга, брахі-, син-, або полідактилія; вроджений вивих кульшових суглобів;
- вроджені очні аномалії: мікрофтальм, звужена очна щілина, гетерохромія райдужної оболонки, ексцентричні зіниці, помутніння кришталика та рогівки, астигматизм, часткова кольорова сліпота, вип’ячування очних яблук;
- аномалії вух: прирослі вушні мочки, отосклероз з туговухістю або глухотою;
- вроджені вади серця;
- інфантилізм;
- пігментні аномалії.
Вираженість анемічного синдрому різна. Частково відмічається помірне зниження гемоглобіну. У деяких хворих анемія взагалі відсутня. Найбільш різка анемізація спостерігається в період гемолітичних кризів, які проявляються посиленням симптомів на тлі безперервного гемолізу. При цьому підвищується температура тіла в зв’язку з масовим розпадом еритроцитів, збільшується інтенсивність жовтяниці, з’являються сильні болі в животі, блювота. Гемолітичні кризи виникають, як правило, після інтеркурентних інфекцій, переохолодження, у жінок в зв’язку з вагітністю.
Гемолітичний криз супроводжується анемією, лейкоцитозом, виявленням в крові нормоцитів, гіперплазією еритроїдного паростка кісткового мозку при незначному збільшенні недиференційованих клітин поряд з спленомегалією, що дає привід до помилкової діагностики деяких форм лейкозів.
При диференціальній діагностиці спадкового мікросфероцитозу з іншими гемолітичними анеміями необхідно виключити аутоімунні гемолітичні анемії.
Спадковий мікросфероцитоз може проявлятися в ранньому віці, що певним чином затруднює діагностику. Як правило, рання маніфестація симтомів хвороби свідчить про важкість перебігу. Характерна рання інтенсивна жовтяниця. Поряд із спленомегалією нерідко також збільшена печінка. В крові підвищений рівень як вільного, так і зв’язаного білірубіну. Така клінічна картина примушує проводити диференціальну діагностику з гемолітичною хворобою новонароджених, гепатитом, механічною жовтяницею. Дані анамнезу, проба Кумбса (фіксовані на еритроцитах аутоантитіла), еритроцитометричні показники, осмотична резистентність еритроцитів, ретикулоцитоз мають суттєве значення для правильної діагностики.
Ускладнення:
При спадковому мікросфероцитозі описані арегенераторні кризи. Під час такого кризу з’являються симптоми гіпоплазії кісткового мозку з ураженням еритроїдного паростка. Подібні арегенераторні стани кісткового мозку короткочасні, однак вони зумовлюють важку анемію та можуть спричинити раптову смерть.
Хвороба Мінковського-Шоффара може ускладнюватись утворенням пігментних каменів в жовчному міхурі та жовчних протоках. В зв’язку з цим у хворих спостерігаються симптоми ангіохолецистіту, паренхіматозного гепатиту з підвищенням рівня прямого білірубіну в крові. Описані випадки тромбозу селезінкової вени з наступними шлунковими кровотечами та симптомами гіперспленізму.
Співвідношення статі: Ч1 : Ж1
Тип успадкування:
Аутосомно-домінантний з неповною пенетрантністю.
Вік маніфестації:
Може проявлятися в період новонародженості, в ранньому дитячому віці і на початку шкільного віку.
Лікування:
Єдиним методом лікування хворих спадковим мікросфероцитозом є спленектомія, яка виявляється ефективною в 100% випадків. Після спленектомії у хворих настає практичне одужання, не дивлячись на те, що еритроцити зберігають свої патологічні властивості. Припинення гемолізу після спленектомії пояснюється видаленням основного плацдарму руйнування мікросфероцитів.
Прогноз:
Відносно благоприємний. Більшість хворих доживає до старості. Вірогідність виникнення захворювання у дітей, якщо один з батьків хворіє на мікросфероцитоз, дещо нижча 50%.
Профілактика: бажана генетична консультація.
Спеціальні рекомендації:
Рання діагностика, динамічне спостереження, спленектомія при важкому перебігу захворювання забезпечують практичне одужання хворих.
Номер з каталогу МІМ:
182900 Spherocytosis, Hereditary; HS
Література:
- Козлова С.И., Семанова Е., Демикова Н.С. Наследственные синдромы и медико-генетическое консультирование.- Ленинград, 1987.- С. 206-207.
- Резнік Б.Я., Зубаренко А.В. Практична гематологія дитячого віку.- Київ, 1989.- С. 362-369.
- Fan – Chеn Mong, Kwang – Shin Cho, Kir – Young Kim. A Case of Congenital Microspherocytosis Requiring Early Splenectomy. Yonsei medical journal 1987;28(3):234-42.
- Morton N., Mackinney A.A., Kosower N.S. at al. Genetics of spherocytosis. Am J. Hum. Genet. 1982;14:170-184.
Переглянуто редакційною колегією I.B.I.S.: 27/11/2002
Синдром Штурге-Вебера
(Sturge-Weber Syndrome)
Оксана Миколаївна Масняк
Лікар-генетик
Рівненського обласного медико-генетичного центру
Рівненського обласного клінічного лікувально-діагностичного центру ім. В. Поліщука
Включення:
- Енцефалофаціальний ангіоматоз;
- Енцефалотригемінальний ангіоматоз;
- Менінгеальний капілярний ангіоматоз.
Виключення:
- Нейрофіброматоз;
- Туберозний склероз;
- Синдром Хіппеля-Ліндау.
Основні діагностичні критерії:
Ангіоматоз шкіри, мозку, сітківки.
Класифікація:
Тип І – невус на двох половинах обличчя, лептоменінгеальні ангіоми, може бути глаукома.
Тип ІІ – ангіома обличчя, може бути глаукома.
Тип ІІІ – ізольована лептоменінгеальна ангіома, глаукома відсутня.
В сучасній літературі виділяють:
- трисимптомну форму (нейроокулокутанеальну) у 17,5 % хворих;
- бісимптомну форму (нейрокутанеальну) у 70% хворих;
- моносимптомну форму (кутанеальну) у 12,5% хворих
Ознаки:
Шкірні ангіоми локалізуються, зазвичай, в ділянці першої або всіх трьох гілок трійчастого нерва, переважно з однієї сторони, у вигляді плям від рожевого до пурпурно-червоного кольору. Ураження очей проявляється ангіоматозним переродженням судинної оболонки, частіше на стороні ангіом, можлива вторинна глаукома. Неврологічні зміни – генералізовані судомні напади, геміплегія, геміпарези – зумовлені ангіоматозним ураженням судинної і м’якої мозкових оболонок, а також вторинною атрофією і склерозуванням кори мозку. Можлива розумова відсталість.
Асоційовані вади:
Мікрогірія, макроцефалія, звивистість судин сітківки, гетерохронія райдужки, відшарування сітківки, страбізм, коарктація аорти, макродактилія, капілярні мальформації за межами обличчя.
Дані обстежень:
- Рентгенографія черепа – кальцифікати з характерним їх розміщенням в тім’яно-потиличній ділянці;
- КТ головного мозку – кортикальна атрофія та інтракортикальна кальцифікація типу “трамвайного шляху”; геміатрофія мозку з розширенням бокового шлуночка;
- МРТ головного мозку – дисплазії кори; геміатрофія, гліоз, демієлінізація; контрастне підсилення – ангіоматозна мальформація; розширення шлуночків;
- ангіографія – збільшення глибоких церебральних або колатеральних вен, зменшення або відсутність вен кори, раннє наповнення крупних вен;
- ЕЕГ – основна активність часто аномальна, міжпівкульна асиметрія, реєструються фокальні і мультифокальні спайки і комплекси пік-хвиля в лобних, лобно-скроневих, центральних або тім’яно-потиличних відділах;
- офтальмологічні дані – ангіоматоз повік, звивисті кон’юнктивальні і епісклеральні судинні сплетіння, одностороння гетерохромія райдужки, хоріоїдальна гемангіома, глаукома; ексудативне відшарування сітківки.
Диференційний діагноз:
Нейрофіброматоз, туберозний склероз, синдром Хіппеля-Ліндау, синдром Кліппеля-Треноне-Вебера, синдром Рандю-Ослера, вторинна глаукома.
Етіологія: на даний час вивчена недостатньо.
Частота виникнення: невідома.
Співвідношення між статями:
Невідоме. Ангіоми шкіри спостерігаються у жінок у 3 рази частіше, ніж у чоловіків.
Вік прояву:
Ангіоми шкіри спостерігаються від народження або з’являються в перші місяці життя дитини. Епілептичні напади діагностуються до 1 року в 50%.
Прогноз:
Якщо наявні часті судоми, спостерігається відставання в розумовому розвитку. Нормальний розвиток може спостерігатись у пацієнтів з повільно прогресуючим перебігом захворювання без тяжкого ураження ЦНС. Смертність складає 3,3–14%, найчастіше зумовлена резистентними судомами.
Ускладнення:
Епілептичні напади, відставання в розумовому розвитку.
Лікування:
Симптоматичне. Хірургічне лікування ангіом шкіри і головного мозку проводять при обмежених, ізольованих ураженнях (кріотерапія, лазеротерапія). Іноді при гемангіомі мозку показана променева терапія.
При прогресуванні енцефалотригемінального ангіоматозу хворі помирають, смерть настає під час епістатусу від набряку головного мозку. Інфекційні хвороби і травми можуть ускладнювати перебіг енцефалотригемінального ангіоматозу і призвести до летальних випадків у зв’язку з розвитком субарахноїдально-паренхіматозних крововиливів.
Номер з каталогу МІМ:
185300 Sturge-Weber Syndrome; SWS.
Література:
- Диагностика и лечение наследственных заболеваний нервной системы у детей. Руководство для врачей /Под ред. В.П. Зыкова.– М: ”Триада-Х”, 2007.– С.92–98.
- Козлова С.И., Демикова Н.С., Семанова Е., Блинникова О.Е. Наследственные синдромы и медико-генетическое консультирование.- М.: Практика, 1996.- C.318-319.
- Birth Defects Compendium. D. Bergsma (ed.). Second Edition. New York, 1979:987.
- Gorlin RJ, Cohen MM, Hennekam RCM. Syndromes of the Head and the Neck. 4th edition. Oxford University Press. 2001:456-459.
- Jones KL. Smith’s Recognizable Patterns of Human Malformations. 6th edition. W.B. Sauders Company. Philadelphia. 2002:572.
Переглянуто редакційною колегією I.B.I.S.: 14/10/2010
Пренатальний біохімічний скринінг
(Prenatal Biochemical Screening)
Н.Ф. Маковей
Завідуюча лабораторією імуноферментного аналізу
Хмельницького клінічного пологового будинку
За даними Всесвітньої організації охорони здоров’я 2,5% всіх новонароджених мають різноманітні вади розвитку; 1,5% з них обумовлені дією шкідливих екзогенних факторів під час вагітності, решта мають переважно генетичну природу. Близько 40-50% ранньої смертності новонароджених (перинатальної) та інвалідності з дитинства також обумовлені спадковими факторами.
Вирішальна роль в комплексі заходів по профілактиці та попередженню спадкових і вроджених хвороб належить пренатальній діагностиці (ПД), яка дозволяє попередити народження дітей з важкими, некоригованими вадами розвитку, з соціально значимими смертельними генетичними та хромосомними захворюваннями, і тим самим зменшити генетичний груз популяції.
ПД спадкових і вроджених хвороб – новий розділ медичної генетики, що виник у 80-х роках ХХ ст., на зіткненні клінічних дисциплін (акушерства, гінекології, неонатології) і фундаментальних наук (патофізіології, біохімії, цитогенетики, молекулярної біології, генетики людини). Її основні наукові завдання знаходяться в області біології розвитку (ембріології) людини і включають вивчення особливостей реалізації генетичної інформації зародка, що розвивається в нормі та при патології на молекулярному, клітинному, тканинному рівнях, на рівні організму та розробку на цій основі оптимальних способів профілактики, діагностики і, в майбутньому, лікування спадкових хвороб.
У практичному плані ПД – це комплекс методів, направлених на діагностику морфологічних, структурних, функціональних чи молекулярних порушень розвитку, що проявляються у вигляді ізольованих або множинних вроджених вад, дизрупцій, деформацій, недорозвинення, хромосомних чи моногенних хвороб, у вадах чи дисфункціях життєво важливих систем органів і тканин, які призводять до важких, нерідко смертельних хвороб у постнатальному періоді.
Завдання ПД як одного із розділів медико–генетичної служби включають:
- Надання майбутнім батькам вичерпної інформації про ступінь ризику народження хворої дитини.
- У випадку високого ризику надання інформації про можливість переривання вагітності і наслідках прийнятого батьками рішення – народити хвору дитину чи перервати вагітність.
- Забезпечення оптимального проведення вагітності і ранньої діагностики внутрішньоутробної патології.
- Визначення прогнозу здоров’я майбутнього потомства.
Методи ПД розділяють на непрямі (об’єктом дослідження є вагітна жінка) і прямі (досліджується сам плід). Останні можуть бути інвазивними та неінвазивними.
Основні методи оцінки стану плода в пренатальній діагностиці вроджених спадкових захворювань
- Непрямі методи (обстеження вагітної):
- Акушерсько–гінекологічні;
- Медико–генетичні (генеалогічні, цитогенетичні, молекулярно–біологічні);
- Бактеріологічні, серологічні;
- Біохімічні скринінгові тести на альфа-фетопротеїн, естріол, хоріонічний гонадотропін та ін.)
- Прямі методи:
- Неінвазивні (ультразвукове сканування, електрокардіографія, рентгенографія та ін.);
- Інвазивні:
- Хоріонбіопсія:
- трансвагінальна;
- трансабдомінальна;
- Плацентоцентез;
- Кордоцентез;
- Фетоскопія;
- Біопсія тканин плода (печінка, селезінка, шкіра, м’язи та ін.)
У даному огляді детальніше зупинимося на біохімічному скринінгу, метою якого є виявлення осіб з високим ступенем ризику виникнення ряду порушень до появи у них клінічних симптомів. Пренатальна біохімічна діагностика використовує визначення концентрації різноманітних сполук (білкових і стероїдних гормонів, амінокислот та ін.), що виробляються організмом матері, плацентою і плодом, для виявлення і моніторингу лікування патологічних станів вагітності, включаючи порушення розвитку плода. При впровадженні біохімічного скринінгу вагітних до уваги приймаються наступні фактори:
- захворювання, виявлене за допомогою скринінгу, чітко розпізнається;
- проведення скринінгу обходиться дешевше, аніж лікування захворювань;
- аналіз, що використовується при скринінгу, повинен бути високоспецифічним (тобто рідко давати хибнопозитивні чи хибнонегативні результати) та високочутливим (виявляти високий процент прихованої форми захворювання).
Слід мати на увазі, що при використанні усіх скринінгових систем, що базуються на визначенні біохімічних маркерів у допологовому періоді, можливе отримання хибнопозитивних результатів, тобто отримання патологічних значень при нормальному розвитку плода. В оптимально налагоджених системах кількість вроджених вад розвитку плода складає 1:20 від кількості позитивних результатів. Водночас, певний відсоток захворювань залишається невиявленим. Кількість хибнонегативних результатів складає 10-20%.
Біохімічні дослідження маркерних сироваткових білків крові вагітних, як і ультразвукове дослідження зараз розглядають як обов’язкові скринінгові методи допологової діагностики, направлені на виявлення жінок груп високого ризику народження дітей із хромосомними аномаліями і вадами розвитку.
До маркерних білків крові матері відносять альфа-фетопротеїн (АФП), хоріонічний гонадотропін (ХГ), вільний некон’югований естріол (НЕ), інгібін-А, асоційований з вагітністю білок плазми А (РАРР-А) та деякі інші. Всі ці білки є ембріонспецифічними, тобто продукуються клітинами самого плода, поступають у кровотік матері. Їх концентрація в сироватці крові зменшується залежно від терміну вагітності та від стану плода. З їх допомогою пренатальний біохімічний скринінг ідентифікує вагітних жінок їз підвищеним ризиком розвитку у плода синдрому Дауна (трисомія 21 хромосоми), синдрому Едвардса (трисомія 18 хромосоми), або вад невральної трубки (ВНТ). Для інших хромосомних хвороб, наприклад, синдрому Тернера, скринінг неспецифічний.
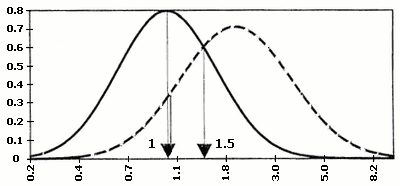
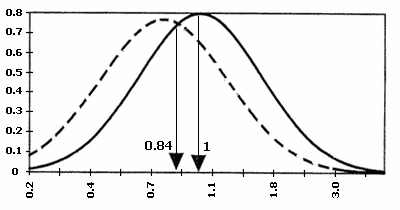
Значення серологічних маркерів можуть мати різноманітні варіації в різних лабораторіях. Для того, щоб коректно порівнювати результати, відхилення рівня маркера від норми виражають, як правило, через кратність медіани. Медіана є середньою серед упорядкованих по зростанню значень рівня маркера при нормальній вагітності того ж терміну гестації – MoM (Multiples of median), наприклад, рівень АФП = 2,5 МоМ, отже, вміст білка в сироватці крові даної вагітної в 2,5 рази вище, ніж медіана (норма) для цього терміну вагітності. Вірогідність народження хворої дитини при певному значенні МоМ розраховано статистично на великій кількості випадків (мал. 1).
Хоріонічний гонадотропін
АФП
Некон‘югований естріол
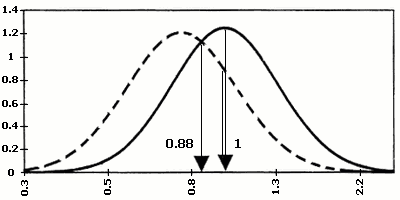
Мал.1. Діаграми розподілу по концентраціях індивідуальних маркерів ХГ, АФП, НЕ
в сироватці крові матері при вагітності плодом з синдромом Дауна та в нормі.
АФП – основний компонент фетальної сироватки на ранніх термінах вагітності – глікопротеїн масою 68 кΔа, синтезується жовточним мішком плода і в 2 триместрі – печінкою плода, а також у незначній кількості він утворюється клітинами кишкового тракту, нирок, плаценти. Білок екскретується в амніотичну рідину з сечею плода, проникає в кров матері через плаценту і всмоктується через плідні оболонки. За своїми фізико-хімічними властивостями АФП близький до сироваткового альбуміну. Функції АФП остаточно не з’ясовані, однак головними із них є: підтримання онкотичного тиску, імуномодуляція; зв’язування материнських естрогенів, участь в органогенезі печінки; властивості транспортного білка. Наприкінці 1 триместру вагітності жовточний мішок атрофується, і основним місцем синтезу АФП стає печінка плоду, звідки цей білок потрапляє у кровообіг плода, утилізується нирками та екскретується із сечею в амніотичну рідину. Далі АФП разом із амніотичною рідиною заковтується плодом і перетравлюється. У кров матері АФП проникає шляхом дифузії, або активного транспорту через плідні оболонки, плаценту, судини пуповини. Вміст АФП у сироватці плода, амніотичній рідині та материнській сироватці визначається гестаційним терміном. Максимальна концентрація АФП у фетальній сироватці спостерігається між 10 та 13 тижнями вагітності, поступово знижуючись до народження. Концентрація АФП в навколоплідних водах строго корелює із його вмістом у крові плода.
Динаміка змін концентрації АФП в материнській сироватці відрізняється: вміст АФП у сироватці матері збільшується з кінця першого триместру (білок виявляється в крові матері, починаючи з 5-6 тижнів), сягаючи максимальних значень на 32-33 тижнях вагітності, далі поступово знижується до пологів. Враховуючи той факт, що фізіологічне збільшення концентрації АФП в крові матері з 13 до 33 тижнів гестації проходить на фоні зниження його вмісту в крові плода, можна припустити, що він безпосередньо відображає проникність плаценти. Особливо це стосується другої половини гестації. На початку ІІ триместру вміст АФП у сироватці вагітної в основному залежить від його дифузії із амніотичної рідини через плідні оболонки.
Оптимальним терміном для дослідження материнської сироватки вважається 15–20 тижні гестації. До 15 тижнів концентрація АФП недостатньо надійна, як маркер дефектів невральної трубки, а понад 20 тижнів рівень АФП характеризує функціональну ступінь зрілості плода.
Вади невральної трубки призводять до виливання фетальної рідини в амніотичну порожнину, внаслідок чого різко збільшується концентрація альфафетопротеїну в крові матері, тому підвищення його рівня в материнській сироватці в 2 триместрі вагітності з високим ступенем вірогідності вказує на наявність у плода вроджених вад невральної трубки. Суттєве підвищення рівня АФП в крові матері спостерігається також при інших патологічних станах (табл. 2). В той же час у 30% випадків хромосомних порушень у плода (синдром Дауна) в діагностичному терміні (15-20 тиждень вагітності) виявляється зниженим (табл. 2).
Таблиця 2. Причини підвищення і зниження
рівня материнського сироваткового АФП під час вагітності.
| Аненцефалія Рахисшис (розщелина хребта) Ембріональна кила Гастрошизис (дефект передньої черевної стінки) Торакоабдомінальний дефект Вроджена відсутність нирок Тератома Гідроцефалія Множинні вади розвитку Гігрома шиї Маловіддя Синдром Меккеля Енцефалоцеле |
Синдром Дауна та інші хромосомні аберації |
| Позаматкова вагітність Прееклампсія Порушення форми плаценти Вірусний гепатит Первинна карцинома печінки Злоякісні пухлини шлунково–кишкового тракту Пухлини зародкового походження |
Цукровий діабет 1-го типу Хоріон аденома Хоріокарцинома |
| Загибель плода Дисфункція плаценти Резус-несумісність |
|
Стан матері та плода, що впливає на материнський рівень АФП
(вірогідність патології плода 90%, за відсутності акушерських причин для підвищення АФП) |
аненцефалія, відкрита спинно-мозкова кила, енцефалоцеле |
відкрите пошкодження у плода |
омфалоцеле, гастрошизис |
||
при аутолізі плода із вивільненням АФП в амніотичну рідину |
||
із сечею плода, підвищення його концентрації в крові плода |
||
АФП, який заковтується плодом разом із амніотичною рідиною |
||
супроводжується шийною гігромою (синдром Тернера, трисомія 13) |
||
(у поєднанні із підвищеним рівнем ХГ) |
||
та самовільного викидня |
АФП в кровотік матері при посиленому скороченні мускулатури матки |
|
ХГ – глікопротеїн, який синтезується трофобластами плаценти, має молекулярну масу 40кΔа, складається з двох субодиниць α і β (α-cубодиниця спільна із гормонами гіпофізу ТТГ, ФСГ, ЛГ, а β-субодиниця визначає специфічність). ХГ виявляється в сироватці крові жінок, починаючи з 10-12 дня після запліднення, тобто на 3-5 день після імплантації. Його концентрація швидко зростає і досягає максимуму на 8-10 тижні вагітності. На перших тижнях вагітності концентрація ХГ подвоюється кожні два дні. Із плаценти ХГ потрапляє переважно в кров матері і там його концентрація у 10-20 разів перевищує відповідну концентрацію у плода. Період напіврозпаду ХГ становить 27 годин, тому повторне його визначення з інтервалом у декілька днів відображатиме істинну зміну його секреції. Біологічна роль ХГ характеризується:
- лютеотрофний ефект: підтримка синтезу прогестерону жовтим тілом яйників у першій третині вагітності та синтез естрогенів плацентою у другій половині вагітності, тобто забезпечення гормонального фону для нормального розвитку вагітності;
- регуляція ендокринної системи плода: стимуляція синтезу стероїдних гормонів у його наднирниках, яйниках чи яєчках;
- пригнічення продукції ФСГ для запобігання появі звичайних менструальних змін в ендометрії;
- запобігання імунологічному відторгненню плода організмом матері.
Рівень ХГ при синдромі Дауна у плода, як правило, підвищується, а при трисомії хромосоми 18 (синдром Едвардса) – знижується. Крім того, зниження рівня ХГ відбувається при вагітності, що не розвивається, та при загрозі її переривання. Зниження відбувається паралельно з прогестероном, що обумовлено порушенням гормональної активності жовтого тіла вагітності. Поряд з ХГ часто використовують також визначення β-субодиниці ХГ, яка має те ж діагностичне значення.
НЕ – фетоплацентарний стероїдний гормон масою 288,4 Δа, один з трьох головних естрогенів, разом з естрадіолом та естроном. Синтезується фетальними печінкою, наднирниками і плацентою, тому є ідеальним показником функції фетоплацентарної системи. На першій стадії синтезу, яка проходить в ембріоні, холестерин, що утворюється de novo, або поступає з крові матері, перетворюється в прегнеколон, який сульфатується корою наднирників плода в дегідроепіандростерон–сульфат. Гідроксилювання цієї сполуки в печінці по 16 α-положенню і відщеплення сульфату сульфатазами плаценти призводить до утворення естріолу. В материнській крові лише 9% естріолу циркулює у вільному стані, більша його кількість знаходиться у вигляді глюкуроніду і сульфату. Під час фізіологічної вагітності рівень некон’югованого естріолу поступово зростає до 40 тижня, безпосередньо характеризуючи функціональний стан плаценти і плода. Недостатній синтез НЕ викликає загрозу переривання вагітності в першій половині і загрозу передчасних пологів в другій. Зниження рівня НЕ спостерігається не лише при синдромі Дауна, а і при вірилізуючій формі вродженої надниркової гіперплазії, при дефіциті плацентарної сульфатази чи 16-α-гідроксилази плоду, аненцефалії, внутрішньоутробній інфекції. Зниження концентрації в плазмі крові більше ніж 35% (при нормі від 4 нмоль/л в 15 тижнів вагітності до 40 нмоль/л при пологах), вказує на гостру недостатність функціонування фетоплацентарного комплексу і є ознакою загрози для плоду. Показниками для дослідження є вагітність з високим ризиком, включаючи цукровий діабет, переношування, прееклампсію, затримку росту плоду, резус–конфлікт, внутрішньоутробну загибель плоду, анемію, порушення харчування, пієлонефрит, захворювання кишківника і гемоглобінопатію, гіпоплазію наднирників плоду, аненцефальний плід.
Інгібін–А – гетеродимерний гормон білкової природи, що гальмує секрецію фолікулостимулюючого гормону (ФСГ) гіпофізом. Інгібін–А складається з α та βА – субодиниць; інгібін–Б – з α- та βВ–субодиниць. Тільки димерні форми володіють біологічною активністю. В першому триместрі вагітності, крім яєчників, синтезуються плодом, плацентою та плідними оболонками. Протягом вагітності підвищується до 10 тижня, потім знижується і залишається стабільним з 15-25 тижня, потім знову зростає до пікових значень перед пологами. Його визначення має діагностичне значення для пренатального скринінгу синдрому Дауна.
Асоційований з вагітністю білок плазми А (РАРР-А) в сироватці крові знаходиться в комплексі головного основного протеїну еозинофілів (proeosinophil major basic protein, proMBP), при чому дві його субодиниці пов’язані з двома ланцюгами останнього дисульфідними містками. Амінокислотна послідовність РАРР-А на значному проміжку унікальна. Лише в С-кінцевому відділі є ділянки, гомологічні білкам системи комплемента і селектинам. Крім того, три фрагменти його ланцюга виявляють подібність з факторами, що регулюють ранню тканинну диференціацію. Білок включено до сімейства α-2-мікроглобулінів людини. РАРР–А є IGF–II-залежною протеазою, що розщеплює IGFВР–4-білок (IGF–II – інсуліноподібний фактор росту ІІ, IGFВР–4-білок, що зв’язує інсуліноподібний фактор росту), та синтезується фібробластами.
РАРР-А пригнічує проліферативну активність лейкоцитів, тому він входить в групу білків–імуносупресорів, до яких відноситься ХГ, трофобластичний β-1-глобулін, АФП і асоційований з вагітністю α-2–глікопротеїн. Ці білки in vivo забезпечують пригнічення імунологічної реактивності материнського організму стосовно зародку, що розвивається.
При вагітності рівень РАРР-А різко збільшується за рахунок синтезу плацентою (протягом перших 8 тижнів вагітності концентрація РАРР-А в сироватці крові подвоюється кожні 4,9 діб, а до 10 тижня збільшується приблизно у 100 разів, градієнтно збільшуючись протягом усієї вагітності, і у багатьох жінок напередодні пологів перевищуючи 100 мкг/мл).
Білок вважається кращим біохімічним маркером 1 триместру для діагностики синдрому Дауна. Має чутливість 42% при 5% хибно позитивних результатів. Молекула білка характеризується високим ступенем глікозилювання, який, імовірно, вищий при вагітності плодом з трисомією 21.
РАРР-А має більшу стійкість до тіолових протеїназ, ніж ХГ, який змінює свій рівень внаслідок протеолітичного розщеплення гормону. Можлива об’єктивна оцінка концентрації РАРР-А при зберіганні (пересиланні поштою) сироватки на паперових фільтрах, що, безумовно, згодом полегшить масовий скринінг вагітних.
Білок–1, зв’язуючий імуноподібні фактори росту (IGFВР–1) – фосфопротеїн з молекулярною масою 25,3 кΔа, зв’язує імуноподібні фактори росту І та ІІ. Це один з 6 структуроподібних білків, що зв’язують та моделюють активність інсуліноподібних факторів росту. Синтезується, насамперед в печінці та децидуальній оболонці, в невеликих кількостях може синтезуватися в клітинах гракулози в лютеальну стадію менструального циклу. Більша концентрація IGFВР–1 була ідентифікована в крові вагітних при нирковій недостатності, недоїданні, при інсулін-залежному цукровому діабеті, цирозі та карциномі печінки. Низькі значення IGFВР–1 знайдено у огрядних пацієнтів і при станах, пов’язаних з гіперінсулінемією. IGFВР–1 відносно вище у випадках внутрішньоутробної затримки росту і нижче у випадках вагітності великим плодом. Сироваткові рівні IGFВР–1 змінюються значно в залежності від характеру харчування.
Діагностичне значення визначення IGFВР–1: Високий рівень в амніотичній рідині пов’язаний з порушенням пренатального росту в 2-3 триместрі вагітності. Він є показником до гістологічного дослідження плаценти на 24-25 тижні вагітності. Збільшується в середньому до 20 раз в загинальному секреті в 75% випадків при розриві фетальної мембрани. Трисомія 18 (синдром Едвардса) діагностується високими значеннями IGFВР–1 в сполученні з низькими концентраціями IGFВР–2 в першому триместрі. Залежно від потужності лабораторій для скринінгу використовують ті чи інші білкові маркери.
Скринінг І триместру
Комбінований тест (виконується на 10-13 тижні вагітності) включає визначення вільної субодиниці β-ХГ людини, РАРР-А і NT (комірцевий простір плоду на УЗД). У першому триместрі РАРР-А і NT, як правило, збільшуються з розвитком вагітності. При розвитку у плода синдрому Дауна рівень РАРР-А в материнській крові, в середньому, в два рази менший. NT збільшений також приблизно в 2 рази порівняно з нормою. В цьому тесті можливо визначити 85% всіх плодів з патологією (близько 5% жінок з групи ризику), проте неможливо визначити дефекти відкриття невральної трубки (немає АФП, оскільки визначення АФП в першому триместрі ще немає діагностичної цінності для даного дефекту)
Скринінг ІI триместру
Квадро–тест (виконується на 15-22 тижні вагітності). Найбільш розповсюджений і загальноприйнятий на сьогодні тест пренатального скринінгу синдрому Дауна і трисомії 18.
Квадро–тест – метод скринінгу з використанням вимірювання чотирьох маркерів в материнській сироватці. Це АФП, ХГ, НЕ та інгібін–А. Ці серологічні маркери і вік жінки використовуються разом для оцінки ризику вагітності плодом з синдромом Дауна. В нормі в другому триместрі рівні АФП і НЕ ростуть (15% і 24% відповідно в тиждень), рівень ХГ зменшується, рівень інгібіну–А повільно знижується перед 17 тижнем і так само повільно зростає після 17 тижня. При вагітності плодом з синдромом Дауна АФП і рівні НЕ, в середньому, нижче Мом на 75%. Якщо використовується скорочений варіант скринінгу, то чутливість виявлення плода із синдромом Дауна набагато нижча:
- При одночасному використанні двох маркерів (АФП і β-ХГ) в сироватці жінок вірогідність діагностики синдрому Дауна у плода складає 59%;
- При визначенні трьох маркерів (так званого “потрійного” тесту: АФП, β-ХГ і НЕ) – 69%;
- При визначенні чотирьох біохімічних маркерів (АФП, β-ХГ, НЕ та інгібіну–А) і з включенням у розрахунки терміну вагітності і віку матері – 79% при 5% рівні хибно позитивних результатів.
Скринінг І та ІІ триместрів
Інтегральний тест (двохетапний пренатальний скринінг синдрому Дауна і трисомії 18) – найбільш ефективний метод скринінгу. Тест виконується в дві стадії:
- Перша стадія – ідеально проводиться в 12 тижнів (проте може бути будь–який проміжок часу між 10 і 13 тижнем), коли береться проба крові на аналіз РАРР-А і паралельно проводиться ультразвукове дослідження NT (комірцевий простір, розвиток кісток носа);
- Друга стадія – включає забір другої проби крові приблизно через 3-4 тижні після забору першого зразка на АФП, ХГ, НЕ та інгібін–А. Оптимально кров береться на 16 тижні вагітності, але можливо зробити аналіз до 22 тижня.
Ці біохімічні маркери + NT + вік жінки використовують для оцінки ступеня ризику.
Інтегральний тест, хоч і заснований на інформації, отриманій від двох зразків для аналізу, і в першому, і в другому триместрі, є новим підходом в пренатальній діагностиці синдрому Дауна. Якщо розрахувати сумісний ризик по результатах інтегрального тесту, то ефективність виявлення синдрому Дауна у плода може досягати 84-90% з 2% хибно позитивних результатів. Це щонайменше на 20% покращує традиційний потрійний тест.
Слід мати на увазі, що найбільш розповсюдженою причиною хибнопозитивних результатів скринінгу буває невірний підрахунок терміну вагітності, тому при невідповідності рівня білка нормі необхідно, в першу чергу, ще раз уточнити термін вагітності за допомогою УЗД.
Нормальними значеннями в діагностичні терміни вважаються рівні білків від 0,5 до 2,5 Мом.
Використання незалежних маркерів (тобто слабко коригованих один з одним) в комбінації збільшує чутливість і специфічність методу і дозволяє прораховувати індивідуальний ризик. Отримані за межею прийнятої норми результати для даних показників вважаються позитивними (див. Табл.3). Вірогідність народження хворої дитини при певному значенні Мом розрахована статистично на великій кількості прикладів. У конкретної пацієнтки вірогідності, отримані для кожного маркера, підсумовуються. Показником для застосування інвазивної пренатальної діагностики з метою каріотипування плода зазвичай рахується ризик народження хворої дитини вище, ніж 1:250 (від 1:190 до 1:400 в різних країнах).
Табл. 3. Рівень в Мом для різних патологій
| Вроджена патологія | ||||||
|---|---|---|---|---|---|---|
| Синдром Дауна | ||||||
| Дефекти закриття нервової трубки | ||||||
| Синдром Едвардса |
Результатом біохімічного скринінгу є відбір вагітних групи ризику народження дітей з вадами невральної трубки (ВНТ) і з хромосомними хворобами плода.Таким вагітним необхідна інвазивна пренатальна діагностика. У випадку високого ризику ВНТ у плода показано ультразвукове дослідження з наступною інвазивною процедурою – амніоцентезом і аналізом амніотичної рідини на вміст АФП і наявність специфічної ізоформи ацетилхолінестерази, характерної для плодів з ВНТ. При відхиленнях маркерних білків, які свідчать про можливість хромосомних хвороб у плода, проводиться інвазивна процедура з метою каріотипування плода. При проведенні скринінгових досліджень вагітну слід інформувати про можливість отримання кваліфікованої інтерпретації результатів лабораторного аналізу і забезпечити при необхідності її направлення на подальшу діагностику.
При масовому скринінгу число вагітних, яким показана інвазивна процедура, як правило, складає близько 5% від загальної кількості обстежених. Важливо розуміти, що позитивні результати (екстремальне відхилення рівня білків від медіани) скринінгу – лише сигнал до більш глибокого обстеження цієї пацієнтки, позаяк хромосомна патологія буде знайдена приблизно у однієї з 50 вагітних цієї групи, а ВНТ – у однієї з 400 обстежених.
Вроджена патологія, включаючи структурні вади, хромосомні аномалії та метаболічні порушення, є однією з найбільш розповсюджених причин перинатальної смертності. На жаль, первинна профілактика охоплює лише малу частину вроджених аномалій. Третинна профілактика, тобто консервативне лікування чи хірургічна корекція, приносить певні результати, проте нерідко пацієнти після складного і тривалого лікування залишаються інвалідами і мають багато проблем. Тому одним з головних резервів зниження рівня перинатальної захворюваності та смертності є вторинна профілактика та пренатальна діагностика вродженої і спадкової патології.
Література:
- Грініо Л.П., Агафонов Б.В. Міопатії.- Москва, 1997. – C. 287.
- Баєв А.А. Вводные замечания //Итоги науки и техники: Геном человека: Т.Г. – Москва: ВИНИТИ, 1994. – C.3-8.
- Карпищенко А.И. Медицинская лабораторная диагностика (программы и алгоритмы). – Санкт–Петербург: Интермедика, 1997. – С. 180–184.
- Компания «Immunotech». Скрининг врожденных пороков развития. – Прага, 1997.
- Гордієнко І.Ю. Пренатальна діагностика вродженої і спадкової патології.
- Mc.Kusick VA. Mendelian inheritance in man: a catalog of human genes and genetic disorders. 11 ed. Baltimore. Johns Hopkins University Press. 1994.
Переглянуто редакційною колегією I.B.I.S.: 12/08/2004
Дослідження ворсинок хоріону
(Chorionic Villus Sampling)
І.Є. Харитонова
Координатор Українського Альянсу
із запобігання вродженим вадам розвитку
Дослідження ворсинок хоріону (ДВХ) – це метод, що застосовується у пренатальній діагностиці (допологове обстеження) і може підтвердити чи виключити хромосомні та деякі спадкові захворювання. Звичайно, це дослідження проводиться між 10 та 12 тижнями вагітності, рахуючи від дати останньої менструації жінки.
Кому рекомендують ДВХ?
Це дослідження не пропонують всім без винятку вагітним жінкам, тому що воно може спровокувати викидень, а можливо і інші ускладнення.
ДВХ проводиться в тих випадках, коли є підвищений ризик виникнення хромосомної патології та спадкових хвороб, і батьки хочуть з’ясувати це під час вагітності якнайраніше. За допомогою іншого пренатального дослідження, що має назву амніоцентез, також можна виявити ті самі генетичні відхилення, але воно проводиться трохи пізніше, звичайно між 15 та 18 тижнями, рахуючи від останньої менструації жінки. Однак останнім часом почали проводити амніоцентез на більш ранніх етапах вагітності (так само, як і дослідження ворсинок хоріону, – у 12 тижнів).
Дослідження ворсинок хоріону пропонується у таких випадках:
- Вік матері. Ризик народження дитини з певними хромосомними захворюваннями підвищується з віком жінки. Якщо жінці на час вагітності 35 років чи більше, лікарі пропонують їй проходження пренатальних досліджень (амніоцентезу чи біопсії ворсинок хоріона) на наявність хромосомної патології. Найбільш поширеною є хвороба Дауна, що є комбінацією розумових і фізичних розладів, спричинених наявністю додаткової хромосоми. Хвороба Дауна трапляється приблизно у одному випадку на 1250 дітей, якщо жінка народила у 20-річному віці. Кількість випадків зростає до одного на кожні 385, коли жінка народжує у 35 років та одного на 106, коли вік матері становить понад 40 років.
- Попередня дитина чи вагітність з хромосомними розладами чи спадковими хворобами. Якщо у подружжя вже є дитина (чи була вагітність) з хромосомними розладами чи спадковими хворобами, вони повинні пройти пренатальне обстеження під час наступних вагітностей.
- Випадки спадкових захворювань у родині. Подружнім парам пропонується пренатальне обстеження, якщо у них вже є нормальна дитина, і, хоча вона не має вроджених аномалій, але в родині є випадки спадкових хвороб чи хромосомних захворювань, існує підвищений ризик успадкувати генетичний розлад. Пренатальне обстеження пропонується тільки у тих випадках, коли генетичні розлади можуть бути виявлені пренатально. Пренатальна діагностика можлива для всіх звичайних хромосомних хвороб, але не для всіх спадкових.
Дослідження ворсинок хоріону небажані, якщо є:
- Вагінальна кровотеча і кров’янисті виділення під час вагітності.
- Якщо в родині вже були випадки вад невральної трубки (вроджені вади спинного чи головного мозку, включно із spina bifida та аненцефалією). Дослідження ворсинок хоріону не встановить цих захворювань. Однак їх можна діагностувати за допомогою амніоцентезу та/або інших досліджень, наприклад, біохімічних.
- Лікар чи лабораторія не мають досвіду в проведенні методик, що використовуються для ДВХ. Можна звернутися до інших медичних закладів. Як альтернатива може бути запропонований амніоцентез.
Що дає ДВХ?
Для проведення дослідження необхідний маленький шматочок ворсинок хоріона, що є тканиною, яка прикріплює плідний мішок до стінки матки. В лабораторії проведуть аналіз клітин ворсинок, які в нормі є такими ж самими за генетичною та біохімічною побудовою як і ембріон. Результати остаточно готові за 10 днів, хоча попередні результати можуть бути готові і раніше.
Яким чином отримуються зразки матеріалу?
Перш за все, піхва та шийка матки ретельно обробляються антисептиком. Потім, під контролем ультразвуку, лікар вводить тонку трубочку-катетер через піхву та шийку матки (трансцервікальний доступ) до місця, де знаходяться ворсинки, і обережно забирає через шприц маленький зразок ворсинок. Існують два доступи для забору ворсинок хоріона. Вони однакові за рівнем безпеки, якщо тільки у жінки немає відхилення матки назад, що може спричинити викидень у тому разі, коли буде надана перевага трансцервікальному доступові. Тому у випадках з такою будовою матки має бути застосований трансабдомінальний доступ (через черевну стінку). Якщо розташування плаценти перешкоджає проведенню цієї процедури, як альтернатива, має бути проведений амніоцентез.
Після взяття зразка матеріалу, поки жінка ще знаходиться у кабінеті лікаря, за допомогою ультразвуку перевіряються серцеві поштовхи плода. Лікарі рекомендують відпочити кілька годин після проведенню ДВХ. Згідно американських досліджень кожна п’ята жінка відчуває після цього дослідження підвищення тонусу матки; кожна третя має невелику кровотечу чи кров’янисті виділення, що звичайно минають за кілька днів.
Чи є ДВХ небезпечним?
В Сполучених Штатах це дослідження проводиться з 1983 року, а в цілому в світі його пройшли більше як 150 тисяч жінок. Статистичні дослідження показують, що ДВХ провокує викидень трохи частіше ніж амніоцентез. Рівень викиднів, що трапляються після амніоцентезу становить менше одного на 200 обстежень. Для біопсії ворсинок хоріона він становить один-два на кожні 100 для жінок з нормальною будовою матки. Цей ризик може зростати до п’яти на 100 викиднів для жінок з відхиленням матки назад, у яких забір матеріалу для дослідження був через трансцервікальний доступ.
Вивчення причин втрати вагітності, що пов’язані з ДВХ показали, що дуже важливим є майстерність лікаря, який виконує цю процедуру. До того ж, найкращі результати мали ті заклади, що практикували як трансцервікальний, так і трансабдомінальний шляхи забору матеріалу, оскільки є можливість вибору безпечнішого доступу для конкретного пацієнта.
В 1991 році з’явилось декілька публікацій про причетність ДВХ до відсутності чи зменшення кількості пальців на руках і ногах у новонароджених, матері яких проходити це дослідження. Ці вади відмічалися переважно тоді, коли ДВХ проводилось раніше 10 тижнів після останнього менструального періода. Зараз повсюди ДВХ роблять тільки у 10 тижнів, або ще пізніше, а жінки мають бути проінформованими про можливість підвищеного ризику вкорочення кінцівок та інших вад розвитку у плода, пов’язаними з технікою проведення процедури.
Чи є добрі результати ДВХ запорукою народження здорової дитини?
Близько 95% жінок з групи ризику, які пройшли пренатальну діагностику, отримують запевнення в тому, що їх ще ненароджена дитина не матиме розладів, на які вони проходили обстеження. Однак, жоден з пренатальних тестів не може гарантувати народження здорової дитини, оскільки тільки певні вади розвитку можна виключити пренатально. Три чи чотири дитини на кожні 100 новонароджених все ж таки мають вроджені вади.
Результати ДВХ у виявленні певних хромосомних вроджених вад і особливих генетичних проблем є дуже точними (більше за 99%). Однак, схоже, що ДВХ дещо більше за амніоцентез дає непевні результати, лишаючи без відповіді запитання, на які часто можна відповісти після проведення амніоцентезу.
Чи може лікар вилікувати вроджені вади за допомогою ДВХ?
Існує багато вроджених вад розвитку та спадкових хвороб, які, на жаль, є невиліковними. Однак, рання пренатальна діагностика за допомогою ДВХ допомагає лікарю у корекції деяких вроджених вад під час вирішальних моментів розвитку плода.
Наприклад, вроджена гіперплазія наднирників, спадкова вада, що виникає внаслідок нестачі важливого фермента, в результаті чого у плода жіночої статі до 16 тижнів вагітності розвиваються аномальні статеві органи. Лікування плода гормонами у критичні терміни розвитку між 10 та 16 тижнями вагітності може запобігти необхідності оперуватись після народження. Зараз, коли відомо, що є ризик гиперплазії наднирників, пренатальна діагностика за допомогою ДВХ може відповісти лікарю на питання чи потрібно проводити подібне лікування.
Якщо для покращення стану плода пренатальне лікування неможливе, а діагноз поставлений до народження, в цих випадках батьки можуть морально підготуватися і планувати разом з лікарем найбезпечніший вибір, місце і метод проведення пологів, а також спеціалістів, що можуть знадобитися відразу після народження.
Чи потрібно мені робити ДВХ?
Проходити чи не проходити пренатальну діагностику, відповідь на це питання отримують під час особистих обговорень між майбутніми батьками та медичними працівниками. Медичні генетики, лікарі, кваліфіковані дорадники з релігійних питань мають надавати батькам допомогу у прийнятті рішення про проходження пренатальної діагностики, а також про інші питання дітонародження. ДВХ проводиться на ранніх етапах вагітності, і рішення має бути дуже зваженим і уважно спланованим, оскільки є ризик щодо плоду. Це тільки одна з причин, чому так важливо щоб жінка отримувала ранню допологову допомогу, починаючи з відвідин лікаря – гінеколога навіть ще до зачаття.
Подружнім парам, яким треба вибирати між ДВХ та амніоцентезом, треба зважати на багато чинників, а саме можливість вибору техніки виконання, стан здоров’я жінки та переваги методу, і що потрібно встановити за проведеними дослідженнями. За одним важливим винятком (вади нервової трубки), ДВХ чи амніоцентез визначають однакові генетичні розлади.
Чи є шляхи зниження ризику вроджених вад?
Є декілька важливих речей, що можуть робити всі жінки, щоб підвищити шанси на здорову вагітність та народження здорової дитини.
- Плануйте вагітність ще до зачаття після консультації з лікарем.
- Вживайте 0,4 мкг фолієвої кислоти (можна у складі полівітамінів) щодня що настання вагітності і протягом перших трьох місяців вагітності – для запобігання вадам нервової трубки.
- Отримуйте ранню та регулярну пренатальну медичну допомогу.
- Споживайте різноманітну їжу.
- До зачаття відрегулюйте свою вагу.
- Не вживайте напоїв, що містять алкоголь під час всієї вагітності.
- Не вживайте наркотиків; якщо є потреба у ліках, повідомте лікаря, що ви вагітні і проконсультуйтесь з ним.
- Не паліть під час вагітності.
Переглянуто редакційною колегією I.B.I.S.: 1/11/2000
Дивіться також:
Скринінг материнської крові
(Maternal Blood Screening)
Тетяна Сороцька
Спеціаліст з інформаційного забезпечення
Рівненського обласного клінічного лікувально-діагностичного центру
У наш час більшість лікарів пропонують своїм вагітним пацієнткам у рутинному порядку (без спеціальних медичних показів) зробити аналіз крові, який вказує, при наявності, на вищий від середнього ризик деяких серйозних вроджених вад, таких як spina bifida (незарощений хребет) та синдром Дауна (хромосомне порушення). За допомогою цього виду аналізу крові, який називається потрійним, можна отримати дуже корисну інформацію про розвиток плоду. При цьому важливо, щоб кожна вагітна жінка пам’ятала, що у більшості випадків позитивний результат аналізу ще не означає, що є проблеми із плодом, і в цьому можна переконатись завдяки подальшим обстеженням.
Які показники вимірюють при потрійному аналізі крові?
На даний момент цей аналіз служить для визначення рівня трьох речовин в материнській крові.
На початку 80-х років, коли тільки почали робити аналіз материнської крові, визначали тільки рівень альфа-фетопротеїну (АФП), речовини, яку виробляє печінка плоду. Якась частина цього протеїну виділяється в амніотичну рідину, що оточує плід. АПФ в невеликій кількості просочується в кров матері, і його концентрація там поступово зростає аж до пізнього періоду вагітності.
Сьогодні за допомогою цього аналізу, поряд з рівнем альфафетопротеїну в сироватці материнської крові (МСАФП), виявляють рівень двох гормонів – естріолу та хоріонічного людського гонадотропіну (ХЛГ). Тому цей аналіз і називається потрійним, хоча інколи його ще називають АФП3 або покращений АФП.
Щонайменше дві з великих лабораторій у Сполучених Штатах почали вимірювати рівень ще одного компоненту материнської крові, який називається інгібін А. Дослідники продовжують вивчати інші речовини в материнській крові, які згодом, можливо, теж будуть вимірювати за допомогою цього аналізу, щоб досягти його більшої ефективності при виявлені вроджених вад.
У лабораторії розраховують індивідуально для кожної жінки ризик народження дитини з вродженими вадами, виходячи з рівня трьох або більше компонентів крові, віку, ваги та расової належності жінки, а також з того, чи хворіє вона на діабет і приймає інсулінове лікування. Ці три останні фактори впливають на рівень МСАФП.
У який період вагітності роблять потрійний аналіз?
Цей вид аналізу найчастіше роблять між 16 і 18 тижнями після останньої менструації. Результати аналізу зазвичай бувають готові через 1 тиждень.
Якщо аналіз показує відхилення від норми, чи означає це, що дитина має вроджені вади?
Ні. За допомогою цього аналізу неможливо діагностувати вроджену ваду, він тільки вказує на підвищений ризик її виникнення. Позитивний результат означає тільки, що треба пройти додаткові обстеження. Серед 1000 жінок, які здають потрійний аналіз крові, 100, як правило, отримують результат з відхиленням від норми. І тільки у 2-3 з цих жінок народжуються діти з вродженими вадами.
Для більшості жінок позитивний результат аналізу означає тільки те, що плід або більший, або менший за віком, ніж вважалось до аналізу. Оскільки, показники норми аналізу різні в різні строки вагітності, дуже важливо знати точний гестаційний вік плоду. Якщо в цьому є труднощі, можна скористатись ультразвуковою діагностикою. Ще один типовий випадок, коли результати показують відхилення від норми, – це вагітність з більш як одним плодом (двійня, трійня, і т.п.)
Жінка, яка не знає, що більшість вагітних з позитивними результатами народжують здорових немовлят, може пережити сильне хвилювання, яке є по суті безпідставним.
При яких проблемах з плодом потрійний аналіз крові показує відхилення від норми?
Дефекти невральної трубки (ДНТ). Підвищений рівень одного з вимірюваних компонентів – МСАФП – викликає припущення про підвищений ризик дефектів невральної трубки. Невральна трубка – це частина ембріону, з якої розвивається головний та спинний мозок. В результаті неправильного зрощення невральної трубки через 4 тижні після запліднення можуть виникнути такі аномалії, як spina bifida (спино-мозкова кила) та аненцефалія. З цими вадами в нашій країні щорічно народжується 2,500 дітей.
Spina bifida, яку ще часто називають “відкритий хребет”, є вродженою аномалією хребта. У більшості випадків цього дефекту спинний мозок мальформований і випинається назовні, що призводить до різних ступенів паралічу ніг та порушень функцій сечового міхура і кишківника. При аненцефалії верхній кінець невральної трубки не закривається, що призводить до тяжких мальформацій мозку та черепу. Немовлята з аненцефалією не виживають.
Причини виникнення ДНТ не вивчені до кінця. Вчені вважають, що ці мальформації викликані генетичними факторами і несприятливим впливом навколишнього середовища. Від 90 до 95% дітей з ДНТ народжується в батьків, які не мають сімейного анамнезу цих захворювань.
Дослідження показують, що ризик ДНТ можна зменшити, якщо жінки репродуктивного віку вживатимуть перед і в перші тижні вагітності фолієву кислоту (вітамін В). Відповідно до рекомендацій Інституту Медицини та організації March of Dimes усім жінкам дітородного віку необхідно щоденно вживати 400 мікрограмів фолієвої кислоти перед заплідненням та у перші місяці вагітності. Жінки повинні притримуватись здорового харчування, включаючи продукти, багаті на фолієву кислоту (апельсиновий сік, боби, листкові зелені овочі, збагачені злакові сніданки) і щоденно приймати полівітаміни. Це єдиний правильний для жінки спосіб отримувати таку кількість фолієвої кислоти, яка їй необхідна.
Підвищення рівня МСАФП може відбутись також внаслідок деяких рідкісних дефектів черевної стінки, нирок або кишківника плоду. У рідких випадках рівень МСАФП високий в результаті вмирання або смерті плоду.
Синдром Дауна. Низькі показники МСФАП та естріолу, і при цьому високий рівень ХЛГ, вказують на підвищений ризик синдрому Дауна. Сьогодні один з вісімсот немовлят народжується з синдромом Дауна. Хворі діти мають характерні риси обличчя, розумове відставання, серцеві аномалії та інші відхилення.
Ризик синдрому Дауна та інших хромосомних захворювань підвищується пропорційно вікові жінки. Зазвичай, вагітним жінкам віком 35 і більше років, пропонують пренатальне обстеження – амніоцентез або біопсію хоріоїдних волокон, щоб діагностувати, а частіше, виключити ці хвороби. Якщо при потрійному аналізі крові виявляється, що жінка до 35 років, має такий самий ризик, як жінки в 35 і старші (приблизно одна на 270), їй також рекомендують пройти подальше пренатальне обстеження.
Яке подальше обстеження рекомендують, якщо потрійний аналіз крові показує відхилення від норми?
При позитивних результатах потрійного аналізу наступним кроком, як правило, є ультразвукова діагностика (УЗД). При УЗ обстеженні використовують звукові хвилі для отримання зображення плоду. Ультразвукова діагностика допоможе встановити гестаційний вік плоду або покаже, що жінка виношує двійню. Якщо відхилення від норми при трійному аналізі виникло в результаті однієї з цих причин, ніякі подальші обстеження не потрібні. При ультразвуковому обстеженні можуть також бути виявлені деякі серйозні вроджені вади.
Якщо УЗД не дала пояснення позитивним результатам аналізу, рекомендується пройти додаткові тести. При підвищеному ризику синдрому Дауна, в результаті потрійного аналізу крові, лікар порадить жінці зробити амніоцентез. Під час цього обстеження лікар через черевну стінку вводить в матку тонку голку і відбирає кілька чайних ложок амніотичної рідини. Ця рідина містить клітини плоду. Саме їх обстежують на синдром Дауна або інше хромосомне захворювання. Амніоцентез дає 99%-у точність при діагностуванні, а частіше виключенні, синдрому Дауна.
Коли потрійний аналіз показує підвищений ризик народження дитини з ДНТ, лікар може рекомендувати жінці пройти УЗД високої точності (2-го рівня), амніоцентез або обидві процедури разом. УЗД високої точності черепу, спинного мозку та інших органів плоду допомагає точно виявити, або виключити, серйозні ДНТ і встановити ступінь тяжкості їх проявів, але таке обстеження можливе тільки у великих медичних закладах. Якщо такий вид обстеження є недоступним, або якщо потрібна більш детальна інформація після проходження УЗД, часто пропонують амніоцентез, щоб встановити рівень АФП в амніотичній рідині. Коли рівень АФП, і усі інші причини виключені, дуже ймовірно, що плід має ДНТ. Після того, як зроблено амніоцентез, клітини плоду перевіряють на хромосомні аномалії, які інколи супроводжують ДНТ або дефекти черевної стінки.
Які переваги дає потрійний аналіз крові?
Для переважної більшості жінок, обстеження дає впевненість в тому, що їхні майбутні діти не мають вроджених вад. Результати також допомагають жінці стежити за нормальним перебігом вагітності. Наприклад, встановлення точного гестаційного віку плоду допомагає перевірити, чи його розвиток відповідає нормі. Або завдяки виявленню кількох плодів, встановлюється спеціальний спосіб спостереження вагітності.
При встановленні діагнозу або припущенні ДНТ або інших захворювань, подружжя має можливість обговорити з кваліфікованими спеціалістами свої подальші дії. Вони можуть спланувати пологи у спеціально обладнаному медичному центрі, з тим щоб дитина могла, в разі потреби, отримати необхідне лікування або хірургічне втручання зразу після народження.
У 1991 році за підтримки March of Dimes Девід Б. Шуртлеф із своїми колегами в Університеті Вашінгтону (Сіетлі) провели дослідження, яке показало, що кесарів розтин, зроблений до настання пологів, облегшує прояви паралічу в дітей з spina bifida. Якщо пренатально був поставлений аналіз spina bifida, жінка може обговорити із своїм лікарем можливість кесаревого розтину.
У деяких випадках буває важко знайти причину позитивних результатів потрійного аналізу. Їх пов’язують з такими відхиленнями, як від’єднання плаценти, передчасні пологи або мала вага дитини при народженні. В результаті ще одного дослідження за підтримки March of Dimes, проведеного Ернестом Хуком з колегами в Університеті Каліфорнії в Беркeлі, було виявлено, що підвищений рівень МСАФП без встановленої причини може бути пов’язаний із підвищеною загрозою смерті плоду в пізній вагітності. Хоча у більшості жінок з підвищеним рівнем МСАФП народжуються живі діти, зроблене відкриття допоможе лікарям запобігти деяким випадкам смерті плоду, провівши ретельне обстеження таких вагітностей у третьому триместрі. Якщо є ознаки ускладнень, в деяких випадках життя дитини може бути врятоване завдяки раннім пологам.
Жінки, старші 35 років, можуть скористатись потрійним аналізом крові у зв’язку з ймовірністю синдрому Дауна перед тим, як вирішать робити чи ні амніоцентез. Так як, при амніоцентезі виникає незначний ризик спонтанного переривання вагітності, деякі жінки намагаються, при можливості, уникнути цієї процедури. Якщо результати потрійного аналізу покажуть, що жінка має низький ризик народження дитини із синдромом Дауна, вона може відмовитись від амніоцентезу. Однак при цьому важливо не забувати, що потрійний аналіз, на відміну від амніоцентезу та біопсії хоріоїдних волокон, не дає можливості виявляти інші хромосомні порушення, так само як і діагностувати чи виключати синдром Дауна.
Переглянуто редакційною колегією I.B.I.S.: 17/10/2000
Дивіться також:
Ультразвукова діагностика
(Ultrasound Test in Pregnancy)
Т. Сороцька
Спеціаліст з інформаційного забезпечення
Українсько-Американської Програми запобігання вродженим вадам розвитку
Ультразвукове діагностування (УЗД) – це техніка, при якій використовують звукові хвилі для отримання зображення дитини (плоду) в утробі матері. УЗД менш шкідливе, ніж рентген, тому що базується на звукових хвилях, а не на променевому випромінюванні. УЗД стало надзвичайно важливою складовою пренатального догляду. Завдяки йому лікарі отримують інформацію, необхідну для планування спостереження за вагітною і поліпшення результату вагітності. Сьогодні у США ультразвукове діагностування проходять 70% вагітних жінок.
Як діє УЗД?
Ультразвуковий пристрій діє за допомогою звукових хвиль, які відштовхуються від тіла плоду. Відлуння, яке при цьому виникає, перетворюється у зображення на моніторі – сонограму. Цю техніку інколи називають сонографією.
Як проводять УЗД?
При скануванні вагітності звукові хвилі спрямовують за допомогою ручного пристрою (трансдьюсеру), проводячи ним назад і вперед по животі вагітної. Щоб отримати чіткіше зображення, на живіт наносять гель; можуть, також, попросити жінку не спорожнювати сечовий міхур перед обстеженням. Звичайне (рутинне) обстеження, воно ще називається базовим або обстеженням І-го рівня, займає від 15 до 20 хвилин. При ньому перевіряють термін вагітності, ріст і розмір плоду, кількість плодів, розташування плаценти, і дивляться, чи немає великих вроджених вад. Якщо виникає підозра вроджених вад, пацієнтку можуть направити на більш детальне обстеження (спрямоване або ІІ-го рівня), при якому використовують складніше ультразвукове обладнання, і яке може тривати від 30 хвилин до кількох годин. Деякі великі медичні центри зараз мають нове ультразвукове устаткування, яке дає тримірний, майже такий чіткий, як фотографія, вигляд плоду (3-D УЗД). Таке обладнання теж можуть використовувати, коли є підозра вроджених вад. УЗД – безболісна процедура, хоча деякі жінки скаржаться на незручність через переповнений сечовий міхур. У ранній період вагітності матка та фаллопієві труби розміщені ближче до вагіни, ніж до поверхні живота. Якщо виникає потреба в діагностиці у малий строк вагітності, звукові хвилі можуть спрямовувати за допомогою зонда, вставленого у вагіну; така техніка називається трансвагінальним УЗД.
Коли використовують УЗД?
УЗД має широке використання при обстеженні вагітності. Воно дає відповідь на безліч запитань, найважливіші з яких:
- Виключення або підтвердження підозрюваної ектопічної вагітності. УЗД може використовуватись для діагностики позаматкової вагітності, розміщеної у фаллопієвих трубах або в черевній порожнині.
- Підтвердження наявності більш, як однієї дитини. УЗД покаже, чи вагітна жінка двійнею, трійнею або має більше число плодів.
- Уточнення терміну вагітності. Розмір плоду, виміряний за допомогою ультразвуку, допомагає лікарям встановити точний строк вагітності.
- Оцінка показників росту плоду. Якщо матка збільшується швидше або повільніше, ніж очікується, за допомогою УЗД можна встановити, чому це відбувається – наприклад, через надлишок амніотичної рідини або слабкий розвиток плоду.
- Оцінка вірогідності спонтанного аборту. Якщо спостерігається кровотеча на початку вагітності, або існує припущення про зупинку серцебиття та рухів плоду, УЗД допоможе встановити, чи плід мертвий, і чи очікується в жінки викидень.
- Встановлення причини кровотечі в другому чи третьому триместрі вагітності. Такі кровотечі часто спричиняються проблемами з плацентою і потребують спеціальних заходів, включаючи кесарів розтин.
- Допомога у проведенні інших видів пренатального обстеження. Якщо вагітній призначені амніоцентез або біопсія хоріоїдних ворсин, лікарі за допомогою УЗД орієнтуються щодо місця видалення клітин для цих видів аналізу.
- Діагностування деяких вроджених вад. Ультразвукове зображення може бути використане для діагностування деяких вроджених вад будови тіла, таких зокрема, як недостатня кількість ребер або spina bifida. За допомогою УЗД діагностують також деякі мальформації внутрішніх органів, наприклад, сечовивідний тракт. Спеціальний різновид УЗД, який називається ехокардіографія, дає змогу простежити рух крові через серцеві камери, шлуночки і великі кровоносні судини плоду і виявити багато видів мальформацій серця та небезпечних для життя аномалій серцевого ритму.
- Перевірка самопочуття плоду на пізній стадії вагітності. Тест, який називається “біофізичний малюнок плоду”, поряд з іншими безстресовими процедурами, включає кілька ультразвукових обстежень (спеціальний моніторинг серцебиття плоду, який призначають, коли у матері є проблеми із здоров’ям, наприклад, цукровий діабет або високий кров’яний тиск, або коли вона переношує). Ультразвукове обстеження включає спостереження за рухами плоду, в тому числі за дихальними рухами та м’язовими тонами, і вимірювання кількості амніотичної рідини.
- Вибір виду пологів. УЗД може мати важливе значення, коли треба визначити, чи є необхідність у кесаревім розтині (або С-розтині) при деяких вагітностях, зокрема, коли плід надто великий або неправильно розташований, або коли плацента блокує вихід з матки.
Чи не шкідливе УЗД?
УЗД вважається нешкідливим для матері і дитини. Ним користуються вже протягом 30 років, і ніяких загроз не було виявлено. Деякі лікарі пропонують жінкам з групи низького ризику у плановому (рутинному) порядку проходити УЗД, щоб перевірити ріст та самопочуття плоду. Хоча, залишається остаточно не вирішеним, чи цим жінкам доцільно взагалі проходити таке обстеження. У 1993 були опубліковані результати великого за обсягом дослідження, яке показало відсутність суттєвої різниці між двома групами жінок з групи низького ризику (одні мали два рутинних УЗ обстеження, інші – пройшли УЗД через якусь встановлену лікарем причину) за такими показниками, як передчасні пологи, вага дитини при народженні, серйозні ускладнення в постнатальний період, смерть новонародженого. Спираючись на ці та подібні дослідження, Американська Колегія Акушерів та Гінекологів рекомендувала проводити УЗД тільки за конкретними медичними показами, такими, які вказані вище.
Чи має протипоказання звичайне (рутинне) УЗД?
Для жінок з групи низького ризику УЗ обстеження корисне для виключення вірогідності проблем, але не дуже ефективне для їх виявлення. У даний час при рутинному УЗД знаходять тільки половину структурних вроджених вад (хоча, згідно досліджень європейських вчених, рутинне УЗД виявляє близько трьох четвертих усіх основних вад розвитку). Деякі дослідження показують, що УЗД найбільш точне, коли його проводить досвідчений спеціаліст, який працює у великому медичному закладі. При рутинному УЗД бувають випадки, коли пропускають вроджену ваду, і, навпаки, коли “знаходять” ваду, якої насправді немає. Приблизно одну з 1000 жінок групи низького ризику помилково попередили про можливість народження дитини з вадою. У таких випадках батьки встигають пережити сильну тривогу, поки подальші обстеження не покажуть, що дитина здорова.
Чи можна вилікувати захворювання, виявлені при УЗД?
Інформацію, отриману при УЗД, часто використовують, щоб внести зміни в заходи пренатального догляду і покращити шанси жінки на народження здорової дитини. Наприклад, виявлене при УЗД порушення серцевого ритму, яке загрожує життю плода, можна лікувати медикаментами ще в утробі матері. Деякі форми непрохідності сечовивідного тракту та інші мальформації лікують хірургічним способом до народження. Виявлення деяких вроджених вад або аномалій плаценти вказують на доцільність кесаревого розтину для більшої безпеки матері і дитини.
Чи є інші способи зменшити ризик вроджених вад розвитку?
УЗД та інші методи пренатальної діагностики допомагають жінці дізнатись, чи є в її дитини вроджені вади або ризик якихось інших відхилень. Знати про ці проблеми до народження дитини – означає, мати час, щоб спланувати її лікування. Існує кілька основних речей, які може зробити кожна жінка, щоб збільшити свій шанс на здорову вагітність і здорову дитину.
- Пройти медичний огляд перед заплідненням.
- Вживати щодня 400 мікрограмів вітаміну В фолієвої кислоти, починаючи це робити до настання вагітності, щоб уникнути важких вроджених вад спинного та головного мозку дитини. Найбільш надійний спосіб вживання фолієвої кислоти – це щоденний прийом мультивітамінів в поєднанні із здоровою дієтою, яка включає їжу, багату на фолієву кислоту, як наприклад, апельсиновий сік та цитрусові, зелені листові овочі, цільні злаки та збагачені сухі сніданки.
- Регулярно, починаючи від раннього строку вагітності, проходити пренатальний медичний огляд.
- Мати нормальну вагу тіла перед заплідненням і набирати від 11 до 15 кг протягом вагітності. (Показник збільшення ваги є індивідуальним для кожної жінки, тому його необхідно узгодити із своїм лікарем).
- Утримуватись від алкогольних напоїв впродовж вагітності.
- Не палити під час вагітності.
- Не вживати ніяких пігулок, навіть загальнопоширених медикаментів, без рекомендації лікаря, який знає, що ви вагітна.
Переглянуто редакційною колегією I.B.I.S.: 5/02/2002
Синдром Ангельмана
(“Радісної маріонетки” синдром)
(Angelman Syndrome)
Наталія Ігорівна Юськів
Лікар-генетик
Волинського обласного дитячого територіального медичного об’єднання
Основні діагностичні критерії:
Розумова відсталість, загальний мовний недорозвиток важкого ступеню, характерна атактична хода (“хода механічної ляльки”: крокування із зігнутими в ліктях руками), мікроцефалія, сплощена потилиця, нижній (мандибулярний) прогнатизм, протрузія язика, пароксизми немотивованого сміху, дифузні зміни на ЕЕГ.
Клінічна характеристика:
Мікроцефалія часто поєднується з гіпотрофією, моторною гіперактивністю та інверсією сну. В ранньому дитинстві відмічається затримка психомовного розвитку важкого ступеню, атаксія та в’ялі посмикування рук. У пацієнтів з синдромом Ангельмана характерний радісний вираз обличчя та приступи (рефлекторні) неадекватного сміху. Постійно відмічається глибока розумова відсталість, хворі здатні виконувати тільки прості інструкції та команди.
В ранньому дитинстві у більшості хворих з’являються епілептичні приступи. На комп’ютерній томограмі виявляють помірну атрофію кори головного мозку та розширення вентрикулярної системи.
ЕЕГ патологічно змінена. Фіксуються генералізовані піки високої амплітуди та повільні хвилі (2-3 ц. за сек.).
Ускладнення:
Пов’язані з епіприступами та атаксією; набуті ортопедичні деформації.
Етіологія:
Синдром Ангельмана відноситься до хвороб, обумовлених геномним імпринтингом (від англ. “imprint” – “відбиток”). Причиною може бути успадкована від матері делеція 15-ї хромосоми (q11-q13), батьківська дисомія 15 (в 3%-5% випадків), точкова мутація активного алеля або мутація імпринтингового центру.
Патогенез:
Основні клінічні прояви є наслідком ураження центральної нервової системи. Мікробрахіцефалія, нижня прогнатія є результатом недорозвитку мозку. Атаксія, пароксизми сміху, алексія, епіприступи та патологічна ЕЕГ є наслідком функціональної дезорганізації ЦНС.
Ризик для сибсів пробанда: приблизно 50%.
Картування генів:
ANCR (Angelman Syndrome Chromosome Region) картований на 15(q11-q13).
Профілактика:
Рекомендоване медико-генетичне консультування.
Лікування:
Раннє навчання “мові жестів” та тренування невербальних навиків може дещо покращити перспективу таких дітей в плані соціальної адаптації. Прогноз щодо розвитку мови – несприятливий. Більшість хворих не мають навиків самообслуговування і потребують сторонньої допомоги протягом цілого життя.
Номер з каталогу МІМ:
105830 Angelman Syndrome, AS
Список літератури:
- Greenberg F. Contiguous gene syndrome. Growth: Genetics and Hormones 1993;9:5-10.
- Lalande M. Parental imprinting and human disease. Annual Review of Genetics 1997;30:173-195.
- Malcom S. Microdeletion and microduplication syndromes. Prenatal Diagnosis 1996;16:1213.
- McKusick VA. Happy Puppet Syndrome. In: Mendelian Inheritance in Man: Catalogs of Autosomal Dominant, Autosomal Recessive, and X-Linked Phenotypes. 10th ed. V. 2. Baltimore: The Johns Hopkins University Press, 1992:1431.
- Williams CA, Frias JL. Angelman Syndrome. In: Buyse ML, ed. Birth Defects Encyclopedia. Dover: Center for Birth Defects Information Services, Inc., 1990:140-141.
Переглянуто редакційною колегією I.B.I.S.: 15/02/2002
Амніоцентез
(Amniocentesis)
Т. Сороцька
Спеціаліст з інформаційного забезпечення
Українсько-Американської Програми
запобігання вродженим вадам розвитку
Амніоцентез – це проста медична процедура, за допомогою якої отримують для аналізу невелику кількість амніотичної рідини, яка оточує плід. Вперше її провели в 1882 році, і з того часу виконують в третьому триместрі вагітності, щоб виміряти рівень анемії при гемолітичній хворобі плоду або дізнатись, чи легені плоду достатньо розвинуті для початку пологів. У даний час амніоцентез часто використовують в другому триместрі вагітності для діагностики, а скоріше для виключення певних вроджених вад.
У яких випадках рекомендують амніоцентез?
Амніоцентез не пропонують усім жінкам, як рутинну (звичайну, без спеціального призначення лікаря) процедуру, тому що вона пов’язана із незначним ризиком спонтанного аборту. Амніоцентез рекомендують, коли існує підвищений ризик хромосомних або генетичних вроджених вад.
За допомогою іншого пренатального тесту, який називається біопсією хоріоїдних волокон (БХВ), можна продіагностувати більше (але не усі) видів вроджених вад, ніж за допомогою амніоцентезу. БХВ роблять на ранній стадії вагітності (зазвичай, між 10 і 12 тижнями), але, при цьому, як було встановлено, виникає трохи більший ризик спонтанного переривання вагітності та інших ускладнень. Деякі дослідження вказують на те, що БХВ пов’язана, також, з дуже незначним ризиком вроджених вад, зокрема, дефектів пальців рук і ніг.
Амніоцентез рекомендують у випадках, пов’язаних із:
- Віком матері. Ризик народження дитини з певними хромосомними вродженими вадами зростає пропорційно вікові матері. Жінкам, віком 35 і старшим, більшість лікарів рекомендують пройти на вибір один з тестів на хромосомні порушення. Найбільш поширеним з таких порушень є синдром Дауна – поєднання фізичних та розумових аномалій, спричинене зайвою хромосомою. Цей синдром трапляється в 1 з 1250 дітей, народжених жінками віком від 20 до 30 років; у віці 35 років вірогідність його виникнення збільшується до 1:385, а в сорок років – до 1:106.
- Наявністю вроджених вад розвитку у попередньої дитини (попередній вагітності). Якщо у подружжя вже народжувалась дитина, або була вагітність, з діагнозом хромосомної аномалії, набору генетичних вроджених вад або дефекту невральної трубки ( див. нижче), при наступній вагітності їм можуть запропонувати пренатальне тестування.
- Іншими аномаліями в родинній історії. Подружжям, в яких не народжувалось хворих дітей, теж можуть запропонувати пройти пренатальне тестування, якщо медичні історії їхніх сімей вказують на те, що нащадки мають підвищений ризик успадкування генетичної хвороби. Пренатальне обстеження буде призначено тільки в тому випадку, якщо підозрювану хворобу можна діагностувати пренатально. Практично усі хромосомні, але не усі генетичні, порушення можна діагностувати пренатально.
- Ймовірність виникнення дефектів невральної трубки. Амніоцентез допомогає в діагностиці дефектів невральної трубки (дефекти спинного та головного мозку, включаючи spina bifida та аненцефалію). Це можливо шляхом виміру рівня речовини, яку виробляє плід, – альфа – фетопротеїну (АФП) в амніотичній рідині. Амніоцентез для вимірювання рівню АФП призначають, коли існує сімейна історія дефектів невральної трубки, або якщо результат аналізу крові матері на АФП показав, що вагітність пов’язана з підвищеним ризиком.
Як роблять амніоцентез?
В амніотичній рідині плавають живі клітини плоду. Їх видаляють із проби амніотичної рідини вагітної жінки, вирощують в лабораторії протягом одного або двох тижнів, і потім перевіряють на хромосомні та генетичні вроджені вади. Результати аналізу можна отримати, зазвичай, через тиждень або два.
В амніотичній рідині міститься також протеїн. Оскільки його можна виміряти безпосередньо, не чекаючи, коли клітини виростуть, аналіз займає усього кілька днів.
Як проходить процедура амніоцентезу?
Ульразвукове зображення дає точну картину розміщення плоду та плаценти, і це дозволяє лікарю вибрати безпечне місце для введення пункційної голки. Далі поверхню живота дезинфікують, лікар вводить в матку тонку голку і відбирає кілька чайних ложок амніотичної рідини. Після того, як проба узята, лікар за допомогою ультразвуку перевіряє серцебиття плоду.
Деякі жінки кажуть, що амніоцентез зовсім безболісна процедура, інші відчувають спазм, коли голка входить у матку, або тиснучий біль протягом кількох хвилин після забору рідини. Після амніоцентезу від одного до двох відсотків жінок скаржаться на біль, мають виділення в місці проколу або витікання рідини. Лікарі рекомендують протягом кількох годин після цієї процедури відпочивати, уникати фізичного навантаження, не піднімати важкого і не стояти протягом довгого часу.
Коли роблять амніоцентез?
Зазвичай, амніоцентез роблять між 15 і 18 тижнями після останньої менструації. У деяких медичних установах рекомендують амніоцентез на ранній стадії, а саме, між 11 та 14 тижнем після останньої менструації. Однак, вважається що ранній амніоцентез можна робити тільки експериментально, а останні дослідження показали, що він пов’язаний з більшим ризиком, ніж амніоцентез в другому чи третьому триместрі вагітності (див. нижче).
У третьому триместрі амніоцентез виконує ще кілька функцій. Його використовують не тільки для того, щоб встановити, чи легені плоду достатньо сформовані у разі необхідності передчасних пологів. Амніоцентез допомагає в діагностиці внутрішньоутробних інфекцій і може, також, бути рекомендований при передчасному розриві навколоплідної оболонки. За допомогою амніоцентезу можна також встановити ступінь анемії плоду при гемолітичній хворобі, щоб вирішити, чи необхідно для збереження життя дитини робити переливання крові.
Чи небезпечний амніоцентез?
Мільйони жінок робили амніоцентез з метою пренатальної діагностики. У 1976 році після ретельних досліджень Національний Інститут Здоров’я повідомив, що триместровий амніоцентез для пренатальної діагностики (при орієнтуванні за допомогою ультразвуку) можна вважати нешкідливим. Однак, з амніоцентезом усе таки пов’язаний незначний ризик спонтанного переривання вагітності. Згідно даних Центру Контролю та Запобігання Захворюванням, показник спонтанних абортів після амніоцентезу коливається від 1:400 до 1:200. При цій процедурі припускається також надзвичайно низький ризик внутрішньоутробної інфекції ( менше, ніж 1 випадок на 1000), яка може привести до спонтанного переривання вагітності.
В процесі досліджень встановлено, що ризик самоаборту після амніоцентезу, зробленого в першому триместрі, може бути в три рази вищий, ніж ризик при друготриместровому амніоценезі. Нещодавно канадськими дослідниками було підраховано, що ризик спонтанного аборту становить 2,6 % після раннього амніоцентезу в порівнянні з 0,8% – при амніоцентезі у другому триместрі. Вони також виявили вражаюче зростання ризику деформації ніг, яка називається клишоногістю, у новонароджених, матерям яких робили амніоцентез на ранній стадії вагітності. Ризик клишоногості зростає в десять разів після раннього амніоцентезу (1,3% проти 0,1% (1:1000) після амніоцентезі в другому триместрі). Описані випадки клишоногості після друготриместрового амніоценезу нічим не відрізняються від випадків в немовлят в США. Спираючись на це та інші дослідження, лікарі змінили своє ставлення до раннього амніоценезу. Багато з них вважають, що, якщо в першому триместрі виникає необхідність в пренатальному тестуванні, то біопсія хоріоїдних волокон є для цього більш безпечною, ніж ранній амніоцентез.
Ризик втрати вагітності в результаті амніоценезу зменшується, якщо процедуру проводить лікар з великим досвідом. Досвідчених спеціалістів, зазвичай, можна знайти у великих медичних установах. Допомогти в цьому може дільничий/ сімейний лікар або лікар-генетик.
Чи означають нормальні результати амніоцентезу, що дитина народиться здоровою?
Більш як 95% жінок з групи підвищеного ризику, які пройшли пренатальну діагностику, отримують підбадьорливу новину про те, що в їхніх дітей не виявлено хвороб, з приводу яких робилось тестування. Однак, жодний пренатальний тест не може гарантувати народження здорової дитини, так як тільки деякі з вроджених вад можуть бути виявлені пренатально. Від 3 до 4 на 100 немовлят мають вроджені вади. Точність даних амніоцентезу при діагностуванні хромосомних аномалій становить від 99,4 до 100 відсотків.
Чи виліковні вроджені вади, діагностовані за допомогою амніоцентезу?
На даний час лікарі здатні продіагностувати набагато більше вроджених вад, ніж вони можуть вилікувати пренатально. Однак, завдяки досягненням пренатальної терапії стало можливим лікування деяких вроджених порушень ще до народження. Прикладом може бути випадок, коли дітей з біотиновою залежністю та метилмалонічною ацидемією (спадкові небезпечні для життя порушення хімічних процесів в організмі), виявленими за допомогою амніоцентезу, лікували в утробі матері, і вони народились здоровими.
Навіть якщо плід має ваду, для якої поки що не існує пренатального лікування, пренатальна діагностика допоможе батькам підготуватись морально і обговорити із своїм лікарем оптимальний час, місце та спосіб пологів з тим, щоб зразу після народження дитини усі необхідні спеціалісти були в їхньому розпорядженні.
Кому потрібно робити амніоцентез?
Батьки майбутньої дитини самостійно вирішують, проходити чи ні пренатальну діагностику, після обговорення цього питання із спеціалістами. Цінну допомогу батькам у прийнятті правильного рішення щодо пренатального обстеження та в інших питаннях, пов”язаних з народженням дитини, можуть надати генетики-консультанти, терапевти, консультанти з релігійних та етичних проблем.
Деякі тести, як напр., БХВ, проводять у ранній період вагітності, і необхідність вирішити, проходити обстеження далі, чи відмовитись від нього, вимагає від лікаря ретельно продуманого і підготовленого обговорення цього питання з пацієнтами. Це ще один доказ на користь того, що кожна жінка повинна на ранній стадії вагітності стати на медичний облік, і відвідати лікаря ще до настання вагітності.
Чи є способи зменшити ризик вроджених вад розвитку?
Існують кілька основних речей, які може зробити кожна жінка, щоб збільшити свій шанс на здорову вагітність і здорову дитину.
- Спланувати вагітність, відвідавши лікаря ще до заплідненням.
- Вживати щодня 400 мікрограмів фолієвої кислоти (кількість, яка зазвичай міститься в полівітамінах), почавши це робити до настання вагітності і продовжуючи протягом першого триместру, щоб запобігти дефектам невральної трубки.
- Регулярно, починаючи від раннього строку вагітності проходити пренатальний медичний огляд.
- Харчуватись різноманітно і поживно.
- Мати нормальну вагу тіла ( бути ні надто повною, ні надто худою) перед заплідненням.
- Утримуватись від алкогольних напоїв впродовж вагітності.
- Не палити під час вагітності.
- Не вживати ніяких пігулок, навіть загальнопоширених медикаментів, без рекомендації лікаря, який знає, що ви вагітна.
Переглянуто редакційною колегією I.B.I.S.: 5/02/2002
Дивіться також:
Синдром амніотичних тяжів
(Amniotic Constricting Band Syndrome)
Лікар ультразвукової діагностики
Рівненського обласного клінічного лікувально-діагностичного центру
Включення:
Аномальні складки шкіри, Адам-комплекс, амніохоріонічні мезобластичні фіброзні тяжі, амніогенні складки, ампутаційний комплекс при амніотичних тяжах, вроджені кільцеві тяжі, вроджений констриктивний синдром, вроджені кругові тяжі і вроджені поперечні дефекти.
Частота:
Синдром зустрічається з частотою 1:1200 – 1:15000 новонароджених.
Співвідношення статей: Ч1 : Ж1
Етіопатогенез:
Синдром амніотичних тяжів – спорадичний стан. Незважаючи на те, що існує декілька теорій, які пояснюють генез синдрому, найбільш розповсюдженою є думка про ранній розрив амніону з утворенням мезодермальних тяжів, що виходять з хоріонічного боку амніону, та їх проникнення в тіло плоду, що, в свою чергу, призводить до ампутації, звуження і вторинних постуральних деформацій внаслідок іммобілізації плоду. Було відмічено, що чим раніше виникають дефекти амніону, тим більше виражені ушкодження плоду. Розрив амніону на першому тижні вагітності призводить до черепно-лицевих деформацій, дефектів внутрішніх органів, тоді як при його розриві в ІІ триместрі вагітності у плода утворюються перетяжки з ампутацією кінцівок і пальців. Альтернативою є думка про те, що синдром амніотичних тяжів – це результат пошкодження, що призводить до типових вад розвитку, пов’язаних з ектодермальними і мезодермальними порушеннями. Судинний фактор також може відігравати роль в патогенезі зовнішнього дефекту. Розвиток синдрому, за даними літератури, можливий після амніоцентезу.
Клінічна картина:
Найчастіше при синдромі амніотичних тяжів зустрічаються такі аномалії, як множинні асиметричні дефекти кінцівок, черепно-лицеві дефекти, вісцеральні дефекти (таб. 1).
Таб. 1. Аномалії, поєднані з синдромом амніотичних тяжів
– Кругові перетяжки кінцівок і пальців; – Ампутація кінцівок і пальців; – Псевдосиндактилія; – Аномальні форми шкірних виростків; – Мавп’ячі складки; – Клишоногість двобічна. |
дефекти: – Енцефалоцеле множинне, асиметричне; – Аненцефалія; – Лицеві розщілини: губи і піднебіння; – Виражені деформації носа; – Асиметрична мікрофтальмія; – Відсутність або недосконалий тип кальцифікації черепа. |
– Гастрошизис; – Омфалоцеле. |
В 77% випадках виявляються множинні аномалії. При енцефалоцеле процес часто буває асиметричний і може бути множинним. Подібна картина майже патогномонічна для синдрому амніотичних тяжів, так як зазвичай ця аномалія буває ізольованою і локалізується по середній лінії. Синдром амніотичних тяжів може бути представлений вираженими аномаліями обличчя, у тому числі анофтальмією, мікрофтальмією і хаотичними множинними розщілинами. Кругові деформації включають два види пошкоджень: ті, що можуть бути пов’язані з руйнівним ефектом тяжів, наприклад, ампутації і кругові перетяжки, і пов’язані з іммобілізацією плоду, наприклад, клишоногість, яка зустрічається у 2/3 всіх випадків. Внутрішні органи не змінені, однак, якщо амніон розривається під час фізіологічної евісцерації вмісту черевної порожнини, мезодермальні тяжі можуть бути причиною таких дефектів розвитку передньої черевної стінки, як гастрошизис і рідше омфалоцеле. У деяких випадках виявляється кифосколіоз.
Фіброзні тяжі, що відходять від поверхні плаценти, часто помітні як проникаючі у тіло плода на рівні виникаючих дефектів. У деяких плодів в результаті амніотичного розриву утворюється зв’язок між порожниною амніону (екстраамніотична вагітність) і екстраембріональним целолом. Плід може вийти з порожнини амніону. Ріст амніону припиняється, і він виявляється після народження дитини у вигляді невеликого мішка, зв’язаного з пуповиною.
На схемі 1 представлено клінічні підходи до оцінки внутрішньоматкових тяжеподібних структур.
Схема 1. Клінічні підходи до оцінки внутрішньоматкових тяжеподібних структур
 Пренатальна діагностика:
Пренатальна діагностика:
Синдром являє собою широкий спектр аномалій, що проявляються у кожному випадку по-різному. Підозра може виникнути, коли нараховується дві аномалії або більше, вказані у таблиці 1. Асиметричне або множинне енцефалоцеле у поєднанні з ампутаціями, дефектами передньої черевної стінки і постуральними деформаціями підвищує вірогідність цієї патології.
Деколи амніотичний тяж можна побачити як лінійну структуру, вільно плаваючу в навколоплідних водах і зв’язану з тілом плода. Однак маловіддя може ускладнити виявлення тяжів. Труднощі виникають при диференційному діагнозі двох станів, які можуть бути причиною візуалізації лінійних ехоструктур, що пересікають порожнину амніону: хоріоамніонічний розподіл і внутрішньоматкові синехії. У цих випадках необхідне сканування плода, спрямоване на пошук з’єднання перегородок з його тілом. Синехії його не мають і не викликають структурних аномалій.
Прогноз:
Прогноз залежить від вираженості аномалій. Їх спектр варіює від незміненого інтелекту у дітей, у яких відмічаються незначні констриктивні дефекти пальців, до множинних важких аномалій, несумісних з життям.
Акушерська тактика:
Необхідне каріотипування плода, оскільки множинні вроджені аномалії можуть бути результатом хромосомних порушень. При виявленні патології до початку періоду життєздатності плода оптимальним методом є переривання вагітності. При встановленні діагнозу після початку періоду життєздатності плода акушерська тактика не змінюється до тих пір, поки не виявляться аномалії, несумісні з життям (аненцефалія, наприклад). У цих випадках оптимальним є обговорення питання з родичами про переривання вагітності на будь-якому її терміні.
Номер з каталогу МІМ:
217100 Constricting Bands, Congenital
Література:
- Козлова С.И., Демикова Н.С. и др. Наследственные синдромы и медико – генетическое консультирование. Л.: Медицина,1987.- C. 28-29.
- Ромеро Р., Пилу Дж. и др. Пренатальная диагностика врожденных пороков развития плода /Пер. с англ.- М.: Медицина,1974.- C.412-414.
- Jones KL. Smith’s recognizable patterns of human malformations. W.B.Sauders Company, California. 1981:636-639.
Переглянуто редакційною колегією I.B.I.S.: 11/03/2002
Спінальна аміотрофія Вердніга-Гоффмана
(Werdnig-Hoffmann Spinal Muscular Atrophy)
Лікар-невролог
Рівненської обласної клінічної дитячої лікарні
Включення:
Хвороба “кволої дитини”.
Визначення:
Основою захворювання є дегенерація рухових клітин передніх рогів спинного мозку.
Основні діагностичні критерії:
- Аутосомно-рецесивний тип успадкування.
- Дебют захворювання – пренатальний період та перші 6 місяців життя.
- Симптомокомплекс “кволої дитини” – генералізована м’язова гіпотонія, слабкість м’язів тулуба та переважно проксимальних відділів кінцівок, фасцикуляції.
- Затримка моторного розвитку.
- Наявність в біоптатах м’язів групувань дрібних круглих волокон, гіпертрофованих волокон І типу та атрофованих волокон І та ІІ типів.
- Ознаки денервації при ЕМГ-дослідженні.
- Швидке прогресування хвороби.
Клінічна картина (перебіг хвороби):
Під час вагітності мати відмічає кволі порухи плоду. Відразу після народження – м’язова гіпотонія, слабкість, зниження або відсутність сухожилкових рефлексів. В окремих випадках ознаки бульбарних розладів: слабкий крик, мляве смоктання, дисфагія, фібриляції м’язів язика. Характерне положення у вигляді розспластаної жаби – з відведеними стегнами та зігнутими колінами. Ураження міжреберних м’язів та діафрагми призводить до виникнення парадоксального дихання. На протязі перших місяців життя відмічаються часті аспірації, респіраторні інфекції. У віці 6 місяців у всіх хворих спостерігається затримка моторного розвитку. Об’єм активних рухів різко обмежений. Інтелект збережений.
Дані лабораторно-інструментальних досліджень:
- Електроміографія – спонтанна біоелектрична активність і синхронізації біопотенціалів (“ритм частоколу”), а у важких випадках – “біоелектричне мовчання”.
- Біопсія м’язів – типова “пучкова” атрофія м’язових волокон.
- Патоморфологічне дослідження – дифузні дегенеративні зміни в передніх рогах спинного мозку, рухових ядрах черепних нервів (V, VI, VII, IX, X, XI, XII пари), хроматолізис, кулеподібне набухання та/ або зморщування моторних клітин, дифузна мікрогліальна та/ або астроцитарна проліферація, часто з утворенням щільних гліальних волокон. Світлова мікроскопія – виявлення атрофованих волокон І та ІІ типів. Характерно скупчення маленьких круглих волокон, які чергуються з гіпертрофованими волокнами, переважно І типу. Електронна мікроскопія: дифузне ушкодження міофібрил, фрагментація саркоплазматичної сітки, зміни Z-смуг, скупчення ядер міоцитів.
- Біохімічний аналіз крові – постійна креатинурія при нормальній активності м’язових ферментів в сироватці крові.
- ДНК-діагностика.
Тип успадкування:
Аутосомно-рецесивний. Частота гетерозиготного носійства складає 1 : 6-80. Ген локалізований на 5q11.2-13.3.
Частота: 1 : 6000 новонароджених.
Співвідношення статей: Ч1 : Ж1.
Вік прояву:
Пренатальний період, період новонародженості, ранній дитячій вік.
Пренатальна діагностика:
- Відставання матки в рості.
- Пізні, кволі рухи плоду.
- Гідрамніон.
- Зміни кількості ребер плода.
- ДНК-діагностика.
Лікування:
- Психологічна підтримка хворих.
- Медикаментозна терапія не існує.
- Проводять випробовування нейротрофічних факторів (циліарного нейротрофічного фактору CNTF і мозкового нейротрофічного фактору BDNF), блокаторів глутаматних рецепторів, інгібіторів супероксиддисмутази.
- Підсадка NAIP-гена в клітини передніх рогів спинного мозку за допомогою генетично змодульованого вектора поліовіруса.
- Симптоматичне лікування м’язової слабкості.
- Механічні пристосування (комірці, бинтування зап’ястків).
- Моторизовані засоби.
- Лікувальна фізкультура (ЛФК).
Номер з каталогу МІМ:
253300 Spinal Muscular Atrophy, Type I; SMA1
Література:
- Козлова С.И., Демикова Н.С., Семанова Е., Блинникова О.Е.. Наследственные синдромы и медико-генетическое консультирование.- М.: Практика, 1996.- С. 174-178.
- Наследственные болезни нервной системы: Рук-во для врачей /Под ред. Ю.Е. Вельтицева, П.А. Темина. – М.: Медицина, 1998.- С. 290-294, 333-343.
- Самуэльс. Неврология.- М., 1997.
- Шанько Г.Г., Бондаренко Е.С. Неврология детского возраста.- Минск, 1990.
- Spinal Muscular Atrophy Type, I; SMA1. OMIM 253300.






