Пренатальний біохімічний скринінг
(Prenatal Biochemical Screening)
Н.Ф. Маковей
Завідуюча лабораторією імуноферментного аналізу
Хмельницького клінічного пологового будинку
За даними Всесвітньої організації охорони здоров’я 2,5% всіх новонароджених мають різноманітні вади розвитку; 1,5% з них обумовлені дією шкідливих екзогенних факторів під час вагітності, решта мають переважно генетичну природу. Близько 40-50% ранньої смертності новонароджених (перинатальної) та інвалідності з дитинства також обумовлені спадковими факторами.
Вирішальна роль в комплексі заходів по профілактиці та попередженню спадкових і вроджених хвороб належить пренатальній діагностиці (ПД), яка дозволяє попередити народження дітей з важкими, некоригованими вадами розвитку, з соціально значимими смертельними генетичними та хромосомними захворюваннями, і тим самим зменшити генетичний груз популяції.
ПД спадкових і вроджених хвороб – новий розділ медичної генетики, що виник у 80-х роках ХХ ст., на зіткненні клінічних дисциплін (акушерства, гінекології, неонатології) і фундаментальних наук (патофізіології, біохімії, цитогенетики, молекулярної біології, генетики людини). Її основні наукові завдання знаходяться в області біології розвитку (ембріології) людини і включають вивчення особливостей реалізації генетичної інформації зародка, що розвивається в нормі та при патології на молекулярному, клітинному, тканинному рівнях, на рівні організму та розробку на цій основі оптимальних способів профілактики, діагностики і, в майбутньому, лікування спадкових хвороб.
У практичному плані ПД – це комплекс методів, направлених на діагностику морфологічних, структурних, функціональних чи молекулярних порушень розвитку, що проявляються у вигляді ізольованих або множинних вроджених вад, дизрупцій, деформацій, недорозвинення, хромосомних чи моногенних хвороб, у вадах чи дисфункціях життєво важливих систем органів і тканин, які призводять до важких, нерідко смертельних хвороб у постнатальному періоді.
Завдання ПД як одного із розділів медико–генетичної служби включають:
- Надання майбутнім батькам вичерпної інформації про ступінь ризику народження хворої дитини.
- У випадку високого ризику надання інформації про можливість переривання вагітності і наслідках прийнятого батьками рішення – народити хвору дитину чи перервати вагітність.
- Забезпечення оптимального проведення вагітності і ранньої діагностики внутрішньоутробної патології.
- Визначення прогнозу здоров’я майбутнього потомства.
Методи ПД розділяють на непрямі (об’єктом дослідження є вагітна жінка) і прямі (досліджується сам плід). Останні можуть бути інвазивними та неінвазивними.
Основні методи оцінки стану плода в пренатальній діагностиці вроджених спадкових захворювань
- Непрямі методи (обстеження вагітної):
- Акушерсько–гінекологічні;
- Медико–генетичні (генеалогічні, цитогенетичні, молекулярно–біологічні);
- Бактеріологічні, серологічні;
- Біохімічні скринінгові тести на альфа-фетопротеїн, естріол, хоріонічний гонадотропін та ін.)
- Прямі методи:
- Неінвазивні (ультразвукове сканування, електрокардіографія, рентгенографія та ін.);
- Інвазивні:
- Хоріонбіопсія:
- трансвагінальна;
- трансабдомінальна;
- Плацентоцентез;
- Кордоцентез;
- Фетоскопія;
- Біопсія тканин плода (печінка, селезінка, шкіра, м’язи та ін.)
У даному огляді детальніше зупинимося на біохімічному скринінгу, метою якого є виявлення осіб з високим ступенем ризику виникнення ряду порушень до появи у них клінічних симптомів. Пренатальна біохімічна діагностика використовує визначення концентрації різноманітних сполук (білкових і стероїдних гормонів, амінокислот та ін.), що виробляються організмом матері, плацентою і плодом, для виявлення і моніторингу лікування патологічних станів вагітності, включаючи порушення розвитку плода. При впровадженні біохімічного скринінгу вагітних до уваги приймаються наступні фактори:
- захворювання, виявлене за допомогою скринінгу, чітко розпізнається;
- проведення скринінгу обходиться дешевше, аніж лікування захворювань;
- аналіз, що використовується при скринінгу, повинен бути високоспецифічним (тобто рідко давати хибнопозитивні чи хибнонегативні результати) та високочутливим (виявляти високий процент прихованої форми захворювання).
Слід мати на увазі, що при використанні усіх скринінгових систем, що базуються на визначенні біохімічних маркерів у допологовому періоді, можливе отримання хибнопозитивних результатів, тобто отримання патологічних значень при нормальному розвитку плода. В оптимально налагоджених системах кількість вроджених вад розвитку плода складає 1:20 від кількості позитивних результатів. Водночас, певний відсоток захворювань залишається невиявленим. Кількість хибнонегативних результатів складає 10-20%.
Біохімічні дослідження маркерних сироваткових білків крові вагітних, як і ультразвукове дослідження зараз розглядають як обов’язкові скринінгові методи допологової діагностики, направлені на виявлення жінок груп високого ризику народження дітей із хромосомними аномаліями і вадами розвитку.
До маркерних білків крові матері відносять альфа-фетопротеїн (АФП), хоріонічний гонадотропін (ХГ), вільний некон’югований естріол (НЕ), інгібін-А, асоційований з вагітністю білок плазми А (РАРР-А) та деякі інші. Всі ці білки є ембріонспецифічними, тобто продукуються клітинами самого плода, поступають у кровотік матері. Їх концентрація в сироватці крові зменшується залежно від терміну вагітності та від стану плода. З їх допомогою пренатальний біохімічний скринінг ідентифікує вагітних жінок їз підвищеним ризиком розвитку у плода синдрому Дауна (трисомія 21 хромосоми), синдрому Едвардса (трисомія 18 хромосоми), або вад невральної трубки (ВНТ). Для інших хромосомних хвороб, наприклад, синдрому Тернера, скринінг неспецифічний.
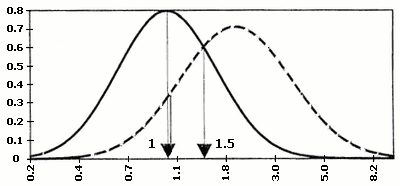
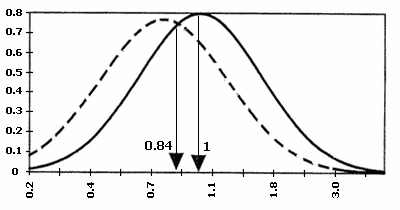
Значення серологічних маркерів можуть мати різноманітні варіації в різних лабораторіях. Для того, щоб коректно порівнювати результати, відхилення рівня маркера від норми виражають, як правило, через кратність медіани. Медіана є середньою серед упорядкованих по зростанню значень рівня маркера при нормальній вагітності того ж терміну гестації – MoM (Multiples of median), наприклад, рівень АФП = 2,5 МоМ, отже, вміст білка в сироватці крові даної вагітної в 2,5 рази вище, ніж медіана (норма) для цього терміну вагітності. Вірогідність народження хворої дитини при певному значенні МоМ розраховано статистично на великій кількості випадків (мал. 1).
Хоріонічний гонадотропін
АФП
Некон‘югований естріол
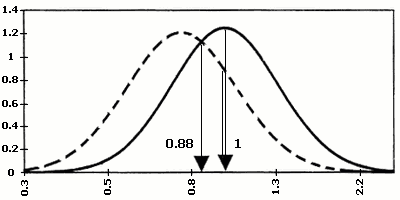
Мал.1. Діаграми розподілу по концентраціях індивідуальних маркерів ХГ, АФП, НЕ
в сироватці крові матері при вагітності плодом з синдромом Дауна та в нормі.
АФП – основний компонент фетальної сироватки на ранніх термінах вагітності – глікопротеїн масою 68 кΔа, синтезується жовточним мішком плода і в 2 триместрі – печінкою плода, а також у незначній кількості він утворюється клітинами кишкового тракту, нирок, плаценти. Білок екскретується в амніотичну рідину з сечею плода, проникає в кров матері через плаценту і всмоктується через плідні оболонки. За своїми фізико-хімічними властивостями АФП близький до сироваткового альбуміну. Функції АФП остаточно не з’ясовані, однак головними із них є: підтримання онкотичного тиску, імуномодуляція; зв’язування материнських естрогенів, участь в органогенезі печінки; властивості транспортного білка. Наприкінці 1 триместру вагітності жовточний мішок атрофується, і основним місцем синтезу АФП стає печінка плоду, звідки цей білок потрапляє у кровообіг плода, утилізується нирками та екскретується із сечею в амніотичну рідину. Далі АФП разом із амніотичною рідиною заковтується плодом і перетравлюється. У кров матері АФП проникає шляхом дифузії, або активного транспорту через плідні оболонки, плаценту, судини пуповини. Вміст АФП у сироватці плода, амніотичній рідині та материнській сироватці визначається гестаційним терміном. Максимальна концентрація АФП у фетальній сироватці спостерігається між 10 та 13 тижнями вагітності, поступово знижуючись до народження. Концентрація АФП в навколоплідних водах строго корелює із його вмістом у крові плода.
Динаміка змін концентрації АФП в материнській сироватці відрізняється: вміст АФП у сироватці матері збільшується з кінця першого триместру (білок виявляється в крові матері, починаючи з 5-6 тижнів), сягаючи максимальних значень на 32-33 тижнях вагітності, далі поступово знижується до пологів. Враховуючи той факт, що фізіологічне збільшення концентрації АФП в крові матері з 13 до 33 тижнів гестації проходить на фоні зниження його вмісту в крові плода, можна припустити, що він безпосередньо відображає проникність плаценти. Особливо це стосується другої половини гестації. На початку ІІ триместру вміст АФП у сироватці вагітної в основному залежить від його дифузії із амніотичної рідини через плідні оболонки.
Оптимальним терміном для дослідження материнської сироватки вважається 15–20 тижні гестації. До 15 тижнів концентрація АФП недостатньо надійна, як маркер дефектів невральної трубки, а понад 20 тижнів рівень АФП характеризує функціональну ступінь зрілості плода.
Вади невральної трубки призводять до виливання фетальної рідини в амніотичну порожнину, внаслідок чого різко збільшується концентрація альфафетопротеїну в крові матері, тому підвищення його рівня в материнській сироватці в 2 триместрі вагітності з високим ступенем вірогідності вказує на наявність у плода вроджених вад невральної трубки. Суттєве підвищення рівня АФП в крові матері спостерігається також при інших патологічних станах (табл. 2). В той же час у 30% випадків хромосомних порушень у плода (синдром Дауна) в діагностичному терміні (15-20 тиждень вагітності) виявляється зниженим (табл. 2).
Таблиця 2. Причини підвищення і зниження
рівня материнського сироваткового АФП під час вагітності.
| Аненцефалія Рахисшис (розщелина хребта) Ембріональна кила Гастрошизис (дефект передньої черевної стінки) Торакоабдомінальний дефект Вроджена відсутність нирок Тератома Гідроцефалія Множинні вади розвитку Гігрома шиї Маловіддя Синдром Меккеля Енцефалоцеле |
Синдром Дауна та інші хромосомні аберації |
| Позаматкова вагітність Прееклампсія Порушення форми плаценти Вірусний гепатит Первинна карцинома печінки Злоякісні пухлини шлунково–кишкового тракту Пухлини зародкового походження |
Цукровий діабет 1-го типу Хоріон аденома Хоріокарцинома |
| Загибель плода Дисфункція плаценти Резус-несумісність |
|
Стан матері та плода, що впливає на материнський рівень АФП
(вірогідність патології плода 90%, за відсутності акушерських причин для підвищення АФП) |
аненцефалія, відкрита спинно-мозкова кила, енцефалоцеле |
відкрите пошкодження у плода |
омфалоцеле, гастрошизис |
||
при аутолізі плода із вивільненням АФП в амніотичну рідину |
||
із сечею плода, підвищення його концентрації в крові плода |
||
АФП, який заковтується плодом разом із амніотичною рідиною |
||
супроводжується шийною гігромою (синдром Тернера, трисомія 13) |
||
(у поєднанні із підвищеним рівнем ХГ) |
||
та самовільного викидня |
АФП в кровотік матері при посиленому скороченні мускулатури матки |
|
ХГ – глікопротеїн, який синтезується трофобластами плаценти, має молекулярну масу 40кΔа, складається з двох субодиниць α і β (α-cубодиниця спільна із гормонами гіпофізу ТТГ, ФСГ, ЛГ, а β-субодиниця визначає специфічність). ХГ виявляється в сироватці крові жінок, починаючи з 10-12 дня після запліднення, тобто на 3-5 день після імплантації. Його концентрація швидко зростає і досягає максимуму на 8-10 тижні вагітності. На перших тижнях вагітності концентрація ХГ подвоюється кожні два дні. Із плаценти ХГ потрапляє переважно в кров матері і там його концентрація у 10-20 разів перевищує відповідну концентрацію у плода. Період напіврозпаду ХГ становить 27 годин, тому повторне його визначення з інтервалом у декілька днів відображатиме істинну зміну його секреції. Біологічна роль ХГ характеризується:
- лютеотрофний ефект: підтримка синтезу прогестерону жовтим тілом яйників у першій третині вагітності та синтез естрогенів плацентою у другій половині вагітності, тобто забезпечення гормонального фону для нормального розвитку вагітності;
- регуляція ендокринної системи плода: стимуляція синтезу стероїдних гормонів у його наднирниках, яйниках чи яєчках;
- пригнічення продукції ФСГ для запобігання появі звичайних менструальних змін в ендометрії;
- запобігання імунологічному відторгненню плода організмом матері.
Рівень ХГ при синдромі Дауна у плода, як правило, підвищується, а при трисомії хромосоми 18 (синдром Едвардса) – знижується. Крім того, зниження рівня ХГ відбувається при вагітності, що не розвивається, та при загрозі її переривання. Зниження відбувається паралельно з прогестероном, що обумовлено порушенням гормональної активності жовтого тіла вагітності. Поряд з ХГ часто використовують також визначення β-субодиниці ХГ, яка має те ж діагностичне значення.
НЕ – фетоплацентарний стероїдний гормон масою 288,4 Δа, один з трьох головних естрогенів, разом з естрадіолом та естроном. Синтезується фетальними печінкою, наднирниками і плацентою, тому є ідеальним показником функції фетоплацентарної системи. На першій стадії синтезу, яка проходить в ембріоні, холестерин, що утворюється de novo, або поступає з крові матері, перетворюється в прегнеколон, який сульфатується корою наднирників плода в дегідроепіандростерон–сульфат. Гідроксилювання цієї сполуки в печінці по 16 α-положенню і відщеплення сульфату сульфатазами плаценти призводить до утворення естріолу. В материнській крові лише 9% естріолу циркулює у вільному стані, більша його кількість знаходиться у вигляді глюкуроніду і сульфату. Під час фізіологічної вагітності рівень некон’югованого естріолу поступово зростає до 40 тижня, безпосередньо характеризуючи функціональний стан плаценти і плода. Недостатній синтез НЕ викликає загрозу переривання вагітності в першій половині і загрозу передчасних пологів в другій. Зниження рівня НЕ спостерігається не лише при синдромі Дауна, а і при вірилізуючій формі вродженої надниркової гіперплазії, при дефіциті плацентарної сульфатази чи 16-α-гідроксилази плоду, аненцефалії, внутрішньоутробній інфекції. Зниження концентрації в плазмі крові більше ніж 35% (при нормі від 4 нмоль/л в 15 тижнів вагітності до 40 нмоль/л при пологах), вказує на гостру недостатність функціонування фетоплацентарного комплексу і є ознакою загрози для плоду. Показниками для дослідження є вагітність з високим ризиком, включаючи цукровий діабет, переношування, прееклампсію, затримку росту плоду, резус–конфлікт, внутрішньоутробну загибель плоду, анемію, порушення харчування, пієлонефрит, захворювання кишківника і гемоглобінопатію, гіпоплазію наднирників плоду, аненцефальний плід.
Інгібін–А – гетеродимерний гормон білкової природи, що гальмує секрецію фолікулостимулюючого гормону (ФСГ) гіпофізом. Інгібін–А складається з α та βА – субодиниць; інгібін–Б – з α- та βВ–субодиниць. Тільки димерні форми володіють біологічною активністю. В першому триместрі вагітності, крім яєчників, синтезуються плодом, плацентою та плідними оболонками. Протягом вагітності підвищується до 10 тижня, потім знижується і залишається стабільним з 15-25 тижня, потім знову зростає до пікових значень перед пологами. Його визначення має діагностичне значення для пренатального скринінгу синдрому Дауна.
Асоційований з вагітністю білок плазми А (РАРР-А) в сироватці крові знаходиться в комплексі головного основного протеїну еозинофілів (proeosinophil major basic protein, proMBP), при чому дві його субодиниці пов’язані з двома ланцюгами останнього дисульфідними містками. Амінокислотна послідовність РАРР-А на значному проміжку унікальна. Лише в С-кінцевому відділі є ділянки, гомологічні білкам системи комплемента і селектинам. Крім того, три фрагменти його ланцюга виявляють подібність з факторами, що регулюють ранню тканинну диференціацію. Білок включено до сімейства α-2-мікроглобулінів людини. РАРР–А є IGF–II-залежною протеазою, що розщеплює IGFВР–4-білок (IGF–II – інсуліноподібний фактор росту ІІ, IGFВР–4-білок, що зв’язує інсуліноподібний фактор росту), та синтезується фібробластами.
РАРР-А пригнічує проліферативну активність лейкоцитів, тому він входить в групу білків–імуносупресорів, до яких відноситься ХГ, трофобластичний β-1-глобулін, АФП і асоційований з вагітністю α-2–глікопротеїн. Ці білки in vivo забезпечують пригнічення імунологічної реактивності материнського організму стосовно зародку, що розвивається.
При вагітності рівень РАРР-А різко збільшується за рахунок синтезу плацентою (протягом перших 8 тижнів вагітності концентрація РАРР-А в сироватці крові подвоюється кожні 4,9 діб, а до 10 тижня збільшується приблизно у 100 разів, градієнтно збільшуючись протягом усієї вагітності, і у багатьох жінок напередодні пологів перевищуючи 100 мкг/мл).
Білок вважається кращим біохімічним маркером 1 триместру для діагностики синдрому Дауна. Має чутливість 42% при 5% хибно позитивних результатів. Молекула білка характеризується високим ступенем глікозилювання, який, імовірно, вищий при вагітності плодом з трисомією 21.
РАРР-А має більшу стійкість до тіолових протеїназ, ніж ХГ, який змінює свій рівень внаслідок протеолітичного розщеплення гормону. Можлива об’єктивна оцінка концентрації РАРР-А при зберіганні (пересиланні поштою) сироватки на паперових фільтрах, що, безумовно, згодом полегшить масовий скринінг вагітних.
Білок–1, зв’язуючий імуноподібні фактори росту (IGFВР–1) – фосфопротеїн з молекулярною масою 25,3 кΔа, зв’язує імуноподібні фактори росту І та ІІ. Це один з 6 структуроподібних білків, що зв’язують та моделюють активність інсуліноподібних факторів росту. Синтезується, насамперед в печінці та децидуальній оболонці, в невеликих кількостях може синтезуватися в клітинах гракулози в лютеальну стадію менструального циклу. Більша концентрація IGFВР–1 була ідентифікована в крові вагітних при нирковій недостатності, недоїданні, при інсулін-залежному цукровому діабеті, цирозі та карциномі печінки. Низькі значення IGFВР–1 знайдено у огрядних пацієнтів і при станах, пов’язаних з гіперінсулінемією. IGFВР–1 відносно вище у випадках внутрішньоутробної затримки росту і нижче у випадках вагітності великим плодом. Сироваткові рівні IGFВР–1 змінюються значно в залежності від характеру харчування.
Діагностичне значення визначення IGFВР–1: Високий рівень в амніотичній рідині пов’язаний з порушенням пренатального росту в 2-3 триместрі вагітності. Він є показником до гістологічного дослідження плаценти на 24-25 тижні вагітності. Збільшується в середньому до 20 раз в загинальному секреті в 75% випадків при розриві фетальної мембрани. Трисомія 18 (синдром Едвардса) діагностується високими значеннями IGFВР–1 в сполученні з низькими концентраціями IGFВР–2 в першому триместрі. Залежно від потужності лабораторій для скринінгу використовують ті чи інші білкові маркери.
Скринінг І триместру
Комбінований тест (виконується на 10-13 тижні вагітності) включає визначення вільної субодиниці β-ХГ людини, РАРР-А і NT (комірцевий простір плоду на УЗД). У першому триместрі РАРР-А і NT, як правило, збільшуються з розвитком вагітності. При розвитку у плода синдрому Дауна рівень РАРР-А в материнській крові, в середньому, в два рази менший. NT збільшений також приблизно в 2 рази порівняно з нормою. В цьому тесті можливо визначити 85% всіх плодів з патологією (близько 5% жінок з групи ризику), проте неможливо визначити дефекти відкриття невральної трубки (немає АФП, оскільки визначення АФП в першому триместрі ще немає діагностичної цінності для даного дефекту)
Скринінг ІI триместру
Квадро–тест (виконується на 15-22 тижні вагітності). Найбільш розповсюджений і загальноприйнятий на сьогодні тест пренатального скринінгу синдрому Дауна і трисомії 18.
Квадро–тест – метод скринінгу з використанням вимірювання чотирьох маркерів в материнській сироватці. Це АФП, ХГ, НЕ та інгібін–А. Ці серологічні маркери і вік жінки використовуються разом для оцінки ризику вагітності плодом з синдромом Дауна. В нормі в другому триместрі рівні АФП і НЕ ростуть (15% і 24% відповідно в тиждень), рівень ХГ зменшується, рівень інгібіну–А повільно знижується перед 17 тижнем і так само повільно зростає після 17 тижня. При вагітності плодом з синдромом Дауна АФП і рівні НЕ, в середньому, нижче Мом на 75%. Якщо використовується скорочений варіант скринінгу, то чутливість виявлення плода із синдромом Дауна набагато нижча:
- При одночасному використанні двох маркерів (АФП і β-ХГ) в сироватці жінок вірогідність діагностики синдрому Дауна у плода складає 59%;
- При визначенні трьох маркерів (так званого “потрійного” тесту: АФП, β-ХГ і НЕ) – 69%;
- При визначенні чотирьох біохімічних маркерів (АФП, β-ХГ, НЕ та інгібіну–А) і з включенням у розрахунки терміну вагітності і віку матері – 79% при 5% рівні хибно позитивних результатів.
Скринінг І та ІІ триместрів
Інтегральний тест (двохетапний пренатальний скринінг синдрому Дауна і трисомії 18) – найбільш ефективний метод скринінгу. Тест виконується в дві стадії:
- Перша стадія – ідеально проводиться в 12 тижнів (проте може бути будь–який проміжок часу між 10 і 13 тижнем), коли береться проба крові на аналіз РАРР-А і паралельно проводиться ультразвукове дослідження NT (комірцевий простір, розвиток кісток носа);
- Друга стадія – включає забір другої проби крові приблизно через 3-4 тижні після забору першого зразка на АФП, ХГ, НЕ та інгібін–А. Оптимально кров береться на 16 тижні вагітності, але можливо зробити аналіз до 22 тижня.
Ці біохімічні маркери + NT + вік жінки використовують для оцінки ступеня ризику.
Інтегральний тест, хоч і заснований на інформації, отриманій від двох зразків для аналізу, і в першому, і в другому триместрі, є новим підходом в пренатальній діагностиці синдрому Дауна. Якщо розрахувати сумісний ризик по результатах інтегрального тесту, то ефективність виявлення синдрому Дауна у плода може досягати 84-90% з 2% хибно позитивних результатів. Це щонайменше на 20% покращує традиційний потрійний тест.
Слід мати на увазі, що найбільш розповсюдженою причиною хибнопозитивних результатів скринінгу буває невірний підрахунок терміну вагітності, тому при невідповідності рівня білка нормі необхідно, в першу чергу, ще раз уточнити термін вагітності за допомогою УЗД.
Нормальними значеннями в діагностичні терміни вважаються рівні білків від 0,5 до 2,5 Мом.
Використання незалежних маркерів (тобто слабко коригованих один з одним) в комбінації збільшує чутливість і специфічність методу і дозволяє прораховувати індивідуальний ризик. Отримані за межею прийнятої норми результати для даних показників вважаються позитивними (див. Табл.3). Вірогідність народження хворої дитини при певному значенні Мом розрахована статистично на великій кількості прикладів. У конкретної пацієнтки вірогідності, отримані для кожного маркера, підсумовуються. Показником для застосування інвазивної пренатальної діагностики з метою каріотипування плода зазвичай рахується ризик народження хворої дитини вище, ніж 1:250 (від 1:190 до 1:400 в різних країнах).
Табл. 3. Рівень в Мом для різних патологій
| Вроджена патологія | ||||||
|---|---|---|---|---|---|---|
| Синдром Дауна | ||||||
| Дефекти закриття нервової трубки | ||||||
| Синдром Едвардса |
Результатом біохімічного скринінгу є відбір вагітних групи ризику народження дітей з вадами невральної трубки (ВНТ) і з хромосомними хворобами плода.Таким вагітним необхідна інвазивна пренатальна діагностика. У випадку високого ризику ВНТ у плода показано ультразвукове дослідження з наступною інвазивною процедурою – амніоцентезом і аналізом амніотичної рідини на вміст АФП і наявність специфічної ізоформи ацетилхолінестерази, характерної для плодів з ВНТ. При відхиленнях маркерних білків, які свідчать про можливість хромосомних хвороб у плода, проводиться інвазивна процедура з метою каріотипування плода. При проведенні скринінгових досліджень вагітну слід інформувати про можливість отримання кваліфікованої інтерпретації результатів лабораторного аналізу і забезпечити при необхідності її направлення на подальшу діагностику.
При масовому скринінгу число вагітних, яким показана інвазивна процедура, як правило, складає близько 5% від загальної кількості обстежених. Важливо розуміти, що позитивні результати (екстремальне відхилення рівня білків від медіани) скринінгу – лише сигнал до більш глибокого обстеження цієї пацієнтки, позаяк хромосомна патологія буде знайдена приблизно у однієї з 50 вагітних цієї групи, а ВНТ – у однієї з 400 обстежених.
Вроджена патологія, включаючи структурні вади, хромосомні аномалії та метаболічні порушення, є однією з найбільш розповсюджених причин перинатальної смертності. На жаль, первинна профілактика охоплює лише малу частину вроджених аномалій. Третинна профілактика, тобто консервативне лікування чи хірургічна корекція, приносить певні результати, проте нерідко пацієнти після складного і тривалого лікування залишаються інвалідами і мають багато проблем. Тому одним з головних резервів зниження рівня перинатальної захворюваності та смертності є вторинна профілактика та пренатальна діагностика вродженої і спадкової патології.
Література:
- Грініо Л.П., Агафонов Б.В. Міопатії.- Москва, 1997. – C. 287.
- Баєв А.А. Вводные замечания //Итоги науки и техники: Геном человека: Т.Г. – Москва: ВИНИТИ, 1994. – C.3-8.
- Карпищенко А.И. Медицинская лабораторная диагностика (программы и алгоритмы). – Санкт–Петербург: Интермедика, 1997. – С. 180–184.
- Компания «Immunotech». Скрининг врожденных пороков развития. – Прага, 1997.
- Гордієнко І.Ю. Пренатальна діагностика вродженої і спадкової патології.
- Mc.Kusick VA. Mendelian inheritance in man: a catalog of human genes and genetic disorders. 11 ed. Baltimore. Johns Hopkins University Press. 1994.







