Serhiy
Біпарієтальний діаметр голови
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”
3, 50 та 97 перцентилі ширини голови (максимальний біпарієтальний діаметр) нанесені на графік відповідно до гестаційного віку. Вимірювання проводились у 87 доношених (48 хлопчиків та 39 дівчаток) та 111 недоношених ізраїльських новонароджених з гестаційним віком від 27 до 41 тижнів. Вимірювання проводились у перші 36-60 годин життя. Жодна дитина не мала вроджених вад. Merlob P et al: Birth Defects: Orig Arts Series XX(7):4, 1984.

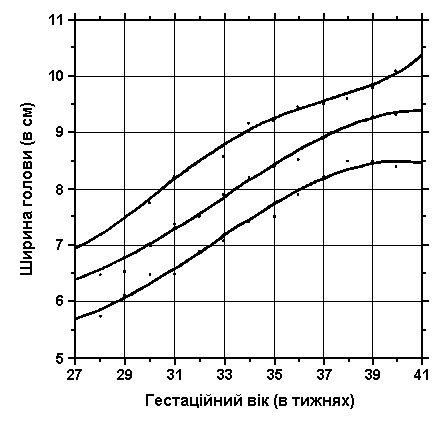
3, 50 та 97 перцентилі індексу ширини голови нанесені на графік відповідно до гестаційного віку.
міжскронева відстань
обвід голови
Див. пояснення вище. Merlob P et al: Birth Defects: Orig Arts Series XX(7):5, 1984.
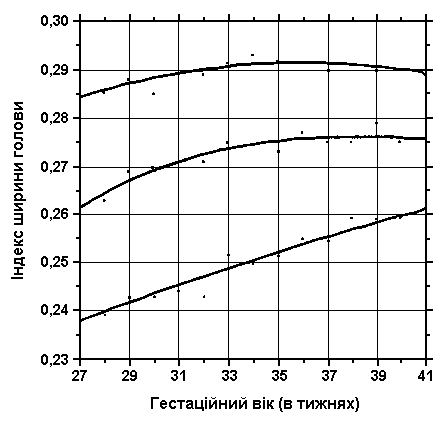
Передньо-задній діаметр голови
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”
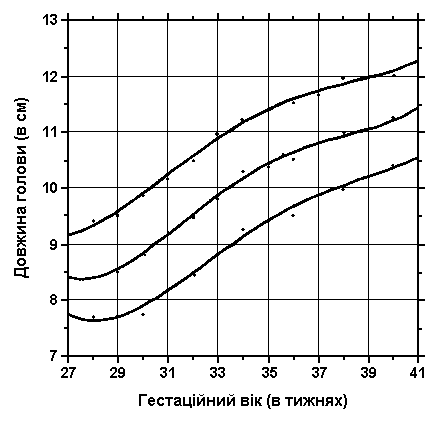
3, 50 та 97 перцентилі довжини голови нанесені на графік відповідно до гестаційного віку. Окружність голови – це відстань від глабели до потиличного виступу. Вимірювання проводились у 87 доношених (48 хлопчиків та 39 дівчаток) та 111 недоношених ізраїльських новонароджених з гестаційним віком від 27 до 41 тижнів. Вимірювання проводились у перші 36-60 годин життя. Жодна дитина не мала вроджених вад. Merlob P et al: Birth Defects: Orig Arts Series XX(7):5, 1984.

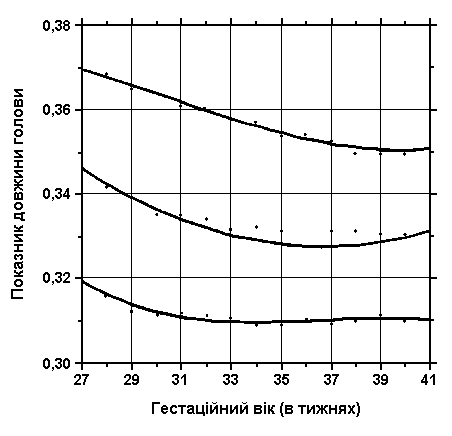
3, 50 та 97 перцентилі індексу довжини голови нанесені на графік відповідно до гестаційного віку.
передньо-задня відстань голови
обвід голови
Див. пояснення вище. Merlob P et al: Birth Defects: Orig Arts Series XX(7):5, 1984.
Синдром раптової дитячої смерті
(Sudden Infant Death Syndrome)
Н.Г. Тандура
Лікар-неонатолог
Волинського обласного дитячого територіального медичного об’єднання
Синдром раптової дитячої смерті (СРДС) – це смерть дитини 1-го року життя, яка наступила раптово, як правило у сні, без попередніх захворювань чи травм. Навіть після повного посмертного дослідження не знаходять патологічних відхилень, які змогли б пояснити смерть.
Частота виникнення синдрому – від 0,04 до 7,3 випадків на 1000 народжених живими.
Причини розвитку СРДС є предметом інтенсивного вивчення.
Відомі обставини при яких, як правило виникає СРДС:
Найбільш небезпечним в плані розвитку СРДС є період між 1-м і 4-м місяцями життя. Частіше СРДС спостерігається у холодну пору року (з жовтня по березень), в другій половині ночі і у вихідні дні.
Приблизно 60% померлих від СРДС становлять хлопчики.
У 30-40% дітей в останні дні їх життя спостерігались легкі прояви респіраторних захворювань. Групу ризику по розвитку СРДС становлять незрілі діти, діти від матерів молодших 20-ти років, на штучному вигодовуванні, діти із сімей, де вже були подібні випадки, від жінок з великою кількістю пологів, з наявністю в анамнезі викиднів. На думку деяких дослідників, у 35% випадках СРДС пов’язаний з низьким соціальним рівнем сімей.
Суттєвим фактором ризику розвитку СРДС вчені вважають положення тіла малюка під час сну.
Найнебезпечнішим є сон дитини на животі. В 6 разів збільшує небезпеку СРДС нікотин, як для активних курців (вагітних), так і для пасивних курців (дітей).
Небезпечним в плані розвитку СРДС є забрудненість повітря, мала вага при народженні (менше 2000 г), перерва між вагітностями менше 1 року, недостатнє харчування вагітних, анемія під час вагітності.
Доведено, що вакцинація не є причиною синдрому раптової дитячої смерті.
При відсутності медичних протипоказів малюку необхідно зробити щеплення. Є версія, що використання сосок-пустишок зменшує ризик розвитку СРДС, можливо, через те, що вони гарантують поступлення свіжого повітря. Однак той факт, що використання пристроїв, що імітують сосок матері, негативно впливає на грудне вигодовування, може в свою чергу підвищувати небезпеку розвитку СРДС.
Профілактика:
Положення під час сну. Положення на животі збільшує ризик СРДС, а сон на спині або на боці може знижувати такий ризик. В основному необхідно, щоб дитина спала на спині або на боці.
Паління. Діти, матері яких під час вагітності або після пологів палять, відносяться до групи підвищеного ризику СРДС. Необхідно, щоб батьки не палили і дитина не зазнавала дії тютюнового диму.
Перегрівання. Немовлята, які довго утримуються при занадто високій температурі або перегріваються через надмірне кутання в пелюшки, мають підвищений ризик СРДС. Дорослі, що доглядають за дітьми, повинні уникати практики, пов’язаної з перегріванням дитини.
Годування груддю. Діти, які ніколи не годувалися грудним молоком, мають підвищений ризик синдрому “смерті у колисці”, порівняно з немовлятами, які годуються грудьми. Грудне вигодовування знижує ризик СРДС втричі.
Переглянуто редакційною колегією I.B.I.S.: 19/12/2002
Синдром раптової дитячої смерті
(Sudden Infant Death Syndrome)
Н.Г. Тандура
Лікар-неонатолог
Волинського обласного дитячого територіального медичного об’єднання
Визначення:
До синдрому раптової дитячої смерті (СРДС) відносять випадки несподіваної ненасильницької смерті дітей віком від 7 до 365 днів, при яких відсутні адекватні для пояснення причини смерті дані анамнезу і патологоанатомічного дослідженнях; причому смерть залишається непоясненою і після детального вивчення обставин, при яких вона відбулася.
Частота:
Рівень малюкової смертності від СРДС коливається в різних країнах від 0,04‰ до 7,3‰.
До регіонів з низьким рівнем смертності від СРДС відносятся Скандинавія (Данія, Фінляндія, Швеція) та Південно-Східна Азія (Гонконг, Японія). Високі показники смертності відмічались в Новій Зеландії, Австралії, Ірландії, Німеччині, Великобританії, США. Завдяки профілактичним заходам відмічається зниження частоти СРДС в Новій Зеландії з 7,3‰ до 2‰, Норвегії з 3,5‰ до 1,6‰, Великобританії з 2,1‰ до 0,6‰.
Патогенез:
У виникненні СДРС велике значення має апное переважно центрального генезу. Запропоновано декілька механізмів, що пояснюють апное.
Незрілість є найбільш імовірним причинним фактором апное. Апное може корелювати з функцією стовбура мозку, а саме із продовженням часу проведення збудження.
Kinney та інші (1995 р.) висунули гіпотезу, що СДРС пов’язаний з відсутністю в холінергічних рецепторах зв’язку з нейронами ядер продовгуватого мозку, що веде до асфіксії під час сну.
Дихання знаходиться у значній залежності від фази сну. Активна або швидка фаза сну (REM) відрізняється нерегулярністю дихального об’єму та частоти дихання. Апное виникає у фазі швидкого сну. Фази швидкого сну переважають у незрілих, недоношених дітей і становлять 60 % від тривалості загального сну, що значно більше ніж у дорослих.
Причиною апное може бути гіпоксія, яка веде до гіпервентиляції з наступною гіповентиляцією і апное. Дихальна реакція на підвищення рівня двоокису вуглецю у дітей з апное послаблена.
У появі апное можуть приймати участь активні рефлекси, що збуджуються стимуляцією задньої частини глотки, роздуттям легенів, рідиною у гортані, деформацією грудної клітки.
Неефективна вентиляція легенів може бути наслідком недостатньої координації дихальних м’язів (діафрагми, міжреберних м’язів) та мускулатури верхнього відділу дихальних шляхів (глотки і гортані).
Хоча більшість новонароджених демонструють центральне апное, при якому вдихальні спроби та повітряний потік припиняються одночасно, також часто спостерігається змішане апное, при якому центральна фаза передує або слідує за припиненням повітряного потоку. Чиста форма обструктивного апное, яке визначається як відсутність повітряного потоку при наявних вдихальних спробах, відмічається набагато рідше. Місце виникнення такого апное-верхня частина глотки.
Кардіальні причини, порушення серцевого ритму, мають велике значення в розвитку СРДС, зокрема подовження інтервалу QT є фактором ризику СРДС (Scwartz 1998 p.). Інші дослідники, спираючись на дані Moss і Robinson (1992 р.) про часту реєстрацію довгого QT, не вважають за доцільне приписувати B-блокатори тисячам дітей з подовженим інтервалом QT для профілактики СРДС.
Treluver і інші (1996 р.) знайшли у дітей з СРДС акумуляцію CYP2C-протеїну, поєднану із значним підвищенням субстанції, що пов’язана з регуляцією судинного тонусу.
Boles і інші (1998 р.), порівнюючи зразки печінкової тканини, в 5% випадках мали порушення жирового окислення у дітей з СРДС.
В виникненні СРДС грає роль і тимомегалія, яка поєднується з гіпоплазією наднирників з тривалим дефіцитом глюкокортикоїдів, що веде до порушення гомеостазу, зниження збудливості в центрах головного мозку, в результаті чого відповідь організму на будь-які впливи зовнішнього середовища стає неадекватною.
Клініка:
Раптова дитяча смерть. Провокуючим фактором СРДС може бути респіраторна вірусна інфекція. Тривалість апное до 20 секунд корелює з частотою СРДС. Апное – це зупинка дихання, яка супроводжується брадикардією (ЧСС 100 ударів на одну хвилину) або ціанозом. Брадикардія та ціаноз проявляються через 20 секунд апное, хоча у глибоконедоношених немовлят можуть з’являтися швидше. Через 30-45 секунд починає спостерігатись блідість та гіпотонія і дитина вже може не реагувати на активну стимуляцію.
Є окремі повідомлення про асоціацію СРДС із злоякісною гіпертермією.
Обставини, при яких частіше зустрічається СРДС:
Найбільш небезпечним в плані розвитку СРДС є період між 1 та 4 місяцями життя. Частіше СРДС спостерігається в холодну пору року (з жовтня по березень), в другій половині ночі і у вихідні дні. Групу ризику по розвитку СРДС становлять незрілі діти, з низькою оцінкою по Апгар, діти, яким проводились реанімаційні заходи, діти на штучному вигодовуванні.
Деякі автори відмічають значимість юного віку матері (менше 20 років), низького зросту (менше 149 см), наявності великої кількості пологів в анамнезі, зменшення інтервалу між вагітностями до 1 року, наявності штучних абортів (більше 3-ох в анамнезі).
Ряд авторів виявили зв’язок між групами крові по системі АВО і ступенем ризику СРДС. Високий ризик СРДС асоціювався з О(І), В(ІП), AB(IV) групами крові.
На думку C. Spurlock та співавторів до 35% випадків СРДС пов’язаний з незадовільними соціальними характеристиками сімей. Наявність шкідливих звичок, зокрема паління, вживання алкоголю, наркотиків підвищує ризик СРДС.
Етіологія:
Причини розвитку СРДС являються предметом інтенсивного вивчення. Описують мультифакторіальний тип передачі і можливо аутосомно-рецесивний. Сіблінгів жертв СРДС традиційно вважають групою високого ризику по розвитку данного синдрому. Ризик розвитку СРДС у них розцінюється як в 4-7 разів вищий ніж у загальній популяції.
Співвідношення статей: Ч3 : Ж2.
Генне картування: невідоме.
Профілактика:
- Положення під час сну.
Положення на животі збільшує ризик СРДС, а сон на спині або на боці може знижувати такий ризик. В основному необхідно, щоб дитина спала на спині або на боці.
- Паління.
Діти, матері яких під час вагітності або після пологів палять, відносяться до групи підвищеного ризику СРДС. Необхідно, щоб батьки не палили і дитина не зазнавала дії тютюнового диму.
- Перегрівання.
Немовлята, які довго утримуються при занадто високій температурі або перегріваються через надмірне кутання в пелюшки, мають підвищений ризик СРДС. Дорослі, що доглядають за дітьми, мають уникати практики, пов’язаної з перегріванням дитини.
- Годування груддю.
Діти, які ніколи не годувалися грудним молоком, мають підвищений ризик синдрому “смерті у колисці”, порівняно з немовлятами, які годуються грудьми. Годування груддю є профілактикою СРДС.
Номер з каталогу МІМ:
272120 Sudden Infant Death Syndrome.
Література:
- Воронцов И.М., Иоакимова Н.В., Кельмансон И.А., Цинзерилинг А.В. //Педиатрия.- 1987.- № 11.- С. 87-90.
- Флетчер Р., Вагнер Э. Клиническая эпидемиология и основы доказательной медицины /Пер. с анг.- М.: Медиасфера, 1998.- С. 352.
- Цинзерлинг А.В., Воронцов И.Н. Иоакимова Н.В. Кельмансон И.А. Синдром внезапной смерти грудных детей.- Метод. реком.- М, 1987.
- Ackerman MJ, Siu BL, Stumer WQ, Tester DJ, Valdivia CR, Makielski JC, Towbin JA. Postmortem molecular analysis of SCN5A defects sudden infant death syndrome. JAMA 2001;286:2264-2269.
- Hovent DL, Kochaner RD, Murphy SL. Deaths final data for 1997 Monthly vital statistic report. Hyattsville Maryland: US Department of Health and Human Services, CDC, National Center for Health Statistics 1999;47:19.
Переглянуто редакційною колегією I.B.I.S.: 26/12/2002
Дитячий церебральний параліч (ДЦП)
(Cerebral Palsy)
І.Є. Харитонова
Координатор Українського Альянсу
із запобігання вродженим вадам розвитку
Церебральний параліч відноситься до групи станів при яких порушується координація рухів та постава. Через ушкодження одного чи декількох відділів мозку, що відповідають за рух, хвора дитина не може нормально рухати м’язами. Хвороба не прогресує, тобто з віком дитини стан її не погіршується. Після проходження лікування більшість дітей можуть значно покращити свої уміння.
У багатьох дітей з церебральним паралічем є інші ускладнення, що потребують лікування. Це – розумова відсталість, складнощі з навчанням, приступи судом, погіршення зору, слуху та вимови.
Як часто зустрічається церебральний параліч?
Звичайно діагноз “церебральний параліч” не ставиться доки дитині не виповнилось 2-3 роки. Кожна друга чи третя дитина на 1000 дітей доросліших 3х років має церебральний параліч. В Сполучених Штатах на церебральний параліч страждають приблизно 500 000 дітей та дорослих різного віку.
Які є типи церебрального паралічу?
Існують три основні типи церебрального паралічу, проте у деяких осіб спостерігаються комбіновані типи ДЦП.
Спастичний церебральний параліч. 70-80% хворих мають спастичний церебральний параліч, при якому м’язи тугі та скуті, що ускладнює рух. Коли уражені обидві ноги (цей стан має назву спастична диплегія), дитині важко рухатись через скуті м’язи стегон та гомілок, що примушує ноги в колінах повертатись всередину та навскіс. В інших випадках вражається одна половина тіла (спастична геміплегія). Найбільш тяжким станом є спастична квадроплегія, за якої ураженими є всі чотири кінцівки та тулуб, часто разом з м’язами рота та язика. Діти з спастичною квадроплегією мають розумову відсталість та інші ускладнення.
Дискінетичний церебральний параліч. 10-20% всіх випадків складає дискінетична форма, що уражає все тіло. Для цієї форми характерна нестійкість тонусу м’язів, що змінюється від розслаблення до повної їх скутості. В деяких випадках до цього приєднуються неконтрольовані рухи, від повільних та ритмічних до швидких та судомних. У дітей часто можуть виникати складнощі з навчанням, бо їм важно добре контролювати своє тіло, щоб сидіти або ходити. Через ураження м’язів обличчя та язика можуть бути складнощі із смоктанням, ковтанням та вимовою.
Атактичний церебральний параліч. Складає від 5 до 10% всіх випадків, при цьому порушується рівновага та координація. Це проявляється хиткою ходою та труднощами у жестикуляції та письмі, які потребують чіткої координації рухів.
Що спричиняє церебральний параліч?
Існує багато факторів впродовж усієї вагітності, що можуть негативно вплинути на розвиток мозку плода, що згодом може призвести довиникнення ДЦП. У 70% випадків мозок уражається ще до народження дитини, однак у деяких випадках це може трапитись незадовго до пологів, чи на перших місяцях (роках) життя. У багатьох випадках причина виникнення церебрального паралічу у дитини лишається невідомою.
- Одним з відомих чинників є інфекційні хвороби, які перенесла мати під час вагітності. Ураження мозку, в результаті якого виникне церебральний параліч, можуть спричинити червінка (краснуха), цитомегаловірусна інфекція та токсоплазмоз – паразитарна інфекція. Нещодавні дослідження встановили, що коли до інфекційного процесу залучаються амніотична рідина, плацента та сечові шляхи, він є важливою причиною церебрального паралічу як у доношених дітей, так і у дітей, які народились передчасно (раніше 37 тижнів вагітності). Дослідження 1998 року, що було проведене Каліфорнійською програмою нагляду за вродженими вадами розвитку, доводить, що доношені діти в 9 разів частіше можуть постраждати на церебральний параліч, якщо вони зазнали впливу інфекції у череві матері. Інфекції статевих та сечових шляхів також підвищують ризик передчасних пологів, ще один чинник ризику церебрального паралічу.
- Кисневе голодування плоду. Виникає при порушенні функцій плаценти, наприклад, при її передчасному (до настання пологів) відшаруванні від стінки матки.
- Передчасне народження (недоношеність). У передчасно народжених дітей, які важать менше 1500 г, церебральний параліч виникає в 30 разів частіше у доношених дітей. Багато з цих крихітних немовлят страждають на крововиливи в головний мозок, що може пошкодити тендітні мозкові тканини чи призвести до перівентрикулярної лейкомаляції – руйнування нервових клітин навколо наповнених рідиною порожнин мозку, (шлуночків мозку).
- Ускладнення під час пологів. Лікарі досі вірять, що асфіксія (гостре кисневе голодування) під час тяжких пологів є у більшості випадків причиною виникнення церебрального паралічу. Нещодавні дослідження показали, що це є причиною тільки у 10% всіх випадків ДЦП.
- Резус-конфлікт. Це несумісність крові матері з її плодом може викликати ураження мозку, що призведе до церебрального паралічу. На щастя, резус – конфлікту можна запобігти, якщо резус-негативній жінці (у якої відсутній резус-фактор) зробити ін’єкцію продукту крові, що має назву Rh-імуноглобулін у 28 тижнів вагітності і ще раз повторити після народження резус-позитивної дитини.
- Інші вроджені вади розвитку. Немовлята з вадами головного мозку, численними генетичними захворюваннями, хромосомними аномаліями та іншими фізичними вродженими вадами знаходяться у групі підвищеного ризику щодо розвитку церебрального паралічу.
- Набутий церебральний параліч. Приблизно 10% дітей з набутим церебральним паралічем отримали його внаслідок ушкодження головного мозку протягом двох перших років життя. Найбільш поширеною причиною таких уражень є інфекції головного мозку, наприклад, менінгіт або травми голови.
Як виявляється церебральний параліч?
Батьки мають уважно придивлятись до розвитку свого немовляти. Потрібно бити тривогу, якщо дитина вчасно не може перевертатися з спинки на живіт, сидіти, повзати або ходити. Батьки завжди повинні обговорювати те, що їх бентежить з лікарем-педіатром, який спостерігає за дитиною.
Діагноз церебрального паралічу базується на тому, як немовля чи більш доросла дитина, рухаються. Лікар зверне увагу на тонус м’язів дитини. Деякі діти з церебральним паралічем мають низький тонус м”язів, що робить їх на вигляд гнучкими. У інших тонус м’язів значно підвищений, тому вони виглядають скутими. Також тонус може змінюватись час від часу, від підвищеного до низького. Лікар перевірить у дитини рефлекси, подивиться чи є у дитини перевага користування правою чи лівою рукою. В той час як більшість немовлят не віддають перевагу правій чи лівій руці (правша чи лівша) до 12 місячного віку, деякі немовлята визначаються з цим вже ще до 6-ти місячного віку. Іншою важливою ознакою церебрального паралічу є стійкість певних рефлексів, що мають назву первинні рефлекси. Вони є нормою у новонароджених і в цілому зникають у віці від 6 до 12 місяців. Лікар також уважно розпитає, щоб зібрати потрібну медичну інформацію і виявити інші вади, що могли призвести до появи патологічної симптоматики.
Лікар також може запропонувати провести деякі обстеження мозку, такі як ядерний магнітний резонанс, компьютерну томографію чи ультразвукове дослідження. Ці дослідження в деяких випадках допомагають визначити причину церебрального паралічу. Ультразвукове дослідження часто рекомендується недоношеним дітям, які мають підвищений ризик ДЦП, щоб допомогти у виявленні аномалії головного мозку, що часто поєднані з церебральним паралічем, і вчасно розпочати лікування. У деяких дітей з ДЦП, особливо з легкими проявами, якщо обстеження головного мозку не виявить аномалій, вважають, що ураженими є мікроскопічно малі частинки мозку, що саме і дає симптоматику. У більше як половини немовлят, яким було поставлено діагноз церебрального паралічу легкого ступеня, з віком симптоми проходять.
Як лікується церебральний параліч?
Бригада лікарів працює з дитиною та родиною, щоб з’ясувати потреби дитини та скласти індивідуальний план лікування, щоб допомогти максимальній реалізації потенціалу дитини. Звичайно бригаду очолює один фахівець, вона може включати педіатра, реабілітолога, ортопеда-хірурга, фізіотерапевта, окуліста, дефектолога, соціального працівника та психолога.
Фізіотерапію починають відразу після уточнення діагнозу. Терапія покращує моторні навички, такі як сидіння чи ходіння, посилює м’язеву силу, допомагає запобігти контрактурам – вкороченню м’язів, що обмежує рухи суглобів. Деколи разом з терапією використовуються фіксуючи пристрої – корсети чи скоби, також шини чи гіпсові пов’язки, які допомагають запобігти контрактурам і покращують функцію рук чи ніг. Якщо контрактури є сильно вираженими, то з метою подовження уражених м’язів, може бути запропоноване хірургічне лікування.
Ліки можуть використовуватись для зменшення спастичності м’язів чи полегшення пересування. На жаль, приймання таблеток не завжди допомагає. Деколи ін’єкції ліків безпосередньо в спастичний м’яз дає кращий ефект, а дія ліків може тривати декілька місяців. Новий тип медикаментозного лікування обіцяє бути корисним для дітей з проявами м’язової спастичності середнього або важкого ступеню, де ураженими є всі чотири кінцівки. Під час хірургічної процедури під шкіру вживлюється насос, що постійно впорскує спазмолітичний препарат баклофен.
Для деяких дітей із спастичним ураженням обох ніг використовують іншу методику, що називається селективна дорзальна різотомія (радікотомія), що може безпосередньо знизити м’язову спастичність та покращити здатність до сидіння, стояння або ходи. Під час цієї процедури лікарі перерізають деякі з нервових волокон, що в найбільшій мірі підтримують м’язову спастичність. Ця процедура звичайно виконується дитині у віці 2-6 років.
Реабілітолог навчає дитину навичкам щоденного життя, як самостійно одягатись, як самостійно їсти. Дітьми з проблемами вимови займається дефектолог, у більш важких випадках дитину навчають користуванню компьютерним синтезатором голосу, що буде говорити замість нього. Для дітей і дорослих з церебральним паралічем комп’ютер став дуже важливим знаряддям навчання, лікування, відпочинку, робочої зайнятості.
Деяким дітям з церебральним паралічем стане у нагоді велика кількість механічних пристроїв, що існує на сьогодні: ходунки, підтримуючи пристрої (допомагають правильно стояти), виготовлені на замовлення крісла на коліщатках, спеціально пристосовані самохідні скутери та триколісні мотоцикли.
Чи можна запобігти церебральному паралічу?
У багатьох випадках причина виникнення церебрального паралічу лишається невідомою, тому нічого не можна вдіяти, щоб йому запобігти. Незважаючи на покращення нагляду за жінками під час вагітності та хворими немовлятами, кількість дітей з церебральним паралічем лише трохи знизилась. Це, до речі, частково за рахунок виживання більшої кількості недоношених дітей, які знаходяться у групі високого ризику щодо церебрального паралічу.
Однак деякі причини церебрального паралічу все ж таки можна виявити, а разом з цим і запобігти виникненню захворювання. Одними з важливих причин є червінка та резус-конфлікт. Зараз резус-конфлікту можна уникнути, якщо резус-негативній жінці надати відповідну медичну допомогу. До настання вагітності жінку можна перевірити на наявність антитіл до вірусу червінки і зробити щеплення, у разі як імунітет відсутній. Травмування дитини у перші місяці можна уникнути, якщо правильно перевозити дитину в машині, пристебнути її та правильно розмістити її на задньому сидінні. Щеплення запобігають виникненню менінгіту, іншої причини ураження мозку на перших місяцях життя (На Україні щеплень проти червінки та менінгіту за календарем щеплень не проводять. Коментарі перекладача.) Жінка може знизити ризик передчасних пологів, якщо вона звернеться за медичною консультацією ще до настання вагітності і буде під регулярним наглядом під час вагітності, кине палити, вживати алкогольні напої та наркотичні засоби.
Переглянуто редакційною колегією I.B.I.S.: 15/02/2002
М’язова дистрофія Дюшенна
(Duchenne Muscular Dystrophy)
Н.О. Афанасьєва
Зав. медико-генетичною консультацією
Кримського республіканського медико-генетичного центру
Клінічного об’єднання “Центр охорони материнства і дитинства”,
Кандидат медичних наук
Основні діагностичні критерії:
- слабкість і атрофія м’язів тазового і плечового поясу, проксимальних відділів верхніх кінцівок;
- псевдогіпертрофія переважно литкових м’язів;
- кардіоміопатія;
- незворотньо-прогресуючий перебіг захворювання.
Клінічна картина:
Починається хвороба у віці 3-5 років, коли з’являється рухова незграбність, втомлюваність при ходьбі, хода набирає “качиного” характеру. Характерні псевдогіпертрофії литкових, рідше інших м’язів, які зменшуються з розвитком процесу. Наростають зміни опорно-рухового апарату: поперековий гіперлордоз, “осина” талія, “крилоподібні” лопатки, в подальшому формуються контрактури суглобів. Нерухомість хворих наступає в середньому через 8-15 років після початку процесу. Причиною смерті частіше буває розвиток дихальної недостатності внаслідок торакодіафрагмальних і респіраторних порушень.
Етіологія:
Моногенне нервово-м’язове захворювання із зчепленим з Х-хромосомою рецесивним типом успадкування.
В останні роки встановлена алельність генів м’язової дистрофії Дюшена (МДД) і м’язової дистрофії Беккера (МДБ), обидві хвороби обумовлені мутаціями гену дистрофіну. Висловлено припущення, що при відсутності синтезу дистрофіну спостерігається МДД, а при зниженні його кількості чи зміні структури молекули дистрофіну – МДБ.
В наш час описано біля 300 різних типів делецій гену дистрофіну. Успішне визначення мутантних генів у хворих дозволило використати молекулярно-генетичні методи для пренатальної діагностики в сім’ях високого ризику МДД/МДБ.
Патогенез:
Ген, відповідальний за розвиток МДД/МДБ, картований на Хр21 і повністю проклонований до 1992 року. Білковим продуктом гену є дистрофін. Точні функції дистрофіну в наш час невідомі, однак можна припустити, що він відіграє важливу роль у формуванні цитоскелету клітини.
Поєднання симптомів:
- розумова відсталість в 40% випадків;
- опорно-руховий апарат: сколіоз, поперековий гіперлордоз, деформації грудної клітки, деформації стоп, контрактури суглобів;
- кардіоміопатія спостерігається у хворих старших 20 років в 60 – 70% випадків.
Тип успадкування:
Зчеплений з Х-хромосомою рецесивний, близько 30% випадків – результат нових мутацій.
Співвідношення статей:
Хворіють хлопчики, однак описані випадки захворювання у дівчаток при наявності структурних аномалій Х-хромосоми, Х-аутосомних транслокацій, при сполучені з синдромом Шерешевського-Тернера.
Популяційна частота:
МДД зустрічається з частотою від 9,7 до 32,6 на 100000 живонароджених хлопчиків. МДБ спостерігається в 4,5-12 разів рідше.
Вік маніфестації:
Як правило, в 3-5 років, хоча може бути і пізніше.
Діагностика:
- клінічні прояви;
- збільшення рівня креатинфосфокінази і інших ферментів в сироватці крові;
- електроміографія з реєстрацією первинно-м’язевого характеру ураження.
Лікування:
- медикаментозна терапія:
- препарати, що впливають на тканинний метаболізм (l-карнитин, коензим-Q10, рибоксин, АТФ, цитомак та інші);
- вітамінотерапія;
- амінокислоти (глутамінова кислота, метионін);
- антихолінестеразні препарати;
- препарати, які покращують периферійний кровообіг (продектин, трентал, теоникол, вазобрал і інші);
- фізіотерапевтичні методи:
- електрофорез з лікарськими препаратами;
- діадинамічні струми;
- електростимуляція;
- озокерит, грязеві аплікації;
- ванни (хвойні, радонові, сіркові);
- оксигенобаротерапія;
- лікувальна фізкультура;
- ортопедична корекція за показами.
Прогноз:
Перебіг МДД швидкопрогресуючий. У віці 10-14 років хворі перестають ходити, до 20-22 років можливий летальний кінець.
Пренатальна діагностика:
Молекулярно-генетичні дослідження хворих МДД/МДБ на виявлення делецій у гені дистрофіну дозволяє проводити пренатальну діагностику у сім’ях високого ризику МДД/МДБ, виявляти гетерозиготного носія у осіб жіночої статі по материнській лінії.
Номер з каталогу МІМ:
- 310200 Muscular Dystrophy, Duchenne Type; DMD
- 253700 Muscular Dystrophy, Limb-Girdle, Autosomal Recessive 5; LGMDR5
- 600119 Sarcoglycan, Alpha; SGCA
Список літератури:
- Темин П.А., Белозеров Ю.М., Никанорова М.Ю., Страхова О.С. Псевдогипертрофическая прогрессирующая мышечная дистрофия Дюшенна //Росс. вестн. перинат. и педиатр.- 1997.- №1.- С.45-53.
- Beggs AH, Koenig M, Boyce FM, Kunkel LM. Exploring the molecular basis for variability among patients with Becker muscular dystrophies: dystrophin gene and protein studies. Am. J. Hum. Genet. 1991;49:54-67.
- Emery AEH. Duchenne muscular dystrophy. London: Oxford University Press. 1987:315 р.
- England SB, Nickolson LVB, Johnson MA et al. Very mild muscular dystrophy associated with the deletion of 46% of dystrophin. Nature 1990;342(6254):180-182.
- Forrest SM, Cross GS, Flint T. et al. Further studies of gene deletions that cause Duchenne and Becker muscula dystrophies. Genomics 1988;2:109-114.
- Politano L, Nigro V, Nigro G. et al. Development of cardiomyopathy in female carriers of Duchenne and Becker muscular dystrophies. JAMA. 1996;May;275 (17):1335-1338.
- Uchino M, Teramoto H, Naoe H. et al. Localization and characterization of dystrophinin the central nervous system of controls and patients with Duchenne muscular dystrophy. J. Neurol. Neurosurg. Psychiatr. 1994;57(5):426-429.
Переглянуто редакційною колегією I.B.I.S.: 05/02/2002
Черепно-ключична дисплазія
(Cleidocranial Dysplasia)
І.Т. Мороз
Лікар-неонатолог
Рівненської обласної дитячої лікарні
Включення:
- Краніо-ключичний дизостоз;
- Клейдокраніальна дисплазія.
Визначення:
Черепно-ключична дисплазія характеризується відсутністю або дисплазією ключиці і аномаліями кісток черепа.
Основні діагностичні критерії:
Аплазія ключиці або її частини, пізнє закриття тім’ячка і осифікація черепних швів, пізнє прорізування зубів.
Клінічна картина:
Даний синдром являє собою генералізовану скелетну дисплазію, яка проявляється черепно – лицевими дизморфіями, відставанням у зрості, недорозвиненням або повною відсутністю (10% хворих) ключиць, що є основним симптомом. Частіше (при гіпоплазії) відсутній акроміальний, рідше – грудний кінець ключиці. При повній відсутності ключиць відмічається опущення надпліччя, вузька грудна клітка. Лопатки крилоподібні. Характерна незвична пластичність (рухливість) в плечових суглобах – дитина може зблизити плечі так, що вони будуть торкатися одне одного. Спостерігається сколіоз, іноді у дуже важкій формі, як ускладнення. Короткі фаланги та гіпоплазія нігтів.
Захворювання може діагностуватись після народження при яскраво виражених ознаках: м’який череп, що може зберігатись до 4-5 років, тім’ячко великих розмірів, яке спереду може дійти до лобних кісток, а ззаду з’єднуватись з малим тім’ячком. Відразу після народження може спостерігатись набряк на голові і в ділянці ключиць. Велике тім’ячко і розходження швів утримуються недовго, але іноді залишаються і у дорослих хворих, що призводить до надмірного розвитку лобних та потиличних горбів. При цьому обличчя залишається маленьким, а очі широко розставлені. Великий потиличний отвір розширений, навколоносові синуси відсутні або дуже малих розмірів. Зуби прорізаються пізно – з 8-9 місяців і пізніше. Іноді кількість молочних зубів більша від норми, вони можуть залишатись до 25-30 років. Розвиток постійних зубів запізнюється і є недосконалим. Зуби, що вже прорізались, деформовані, розміщені неправильно, гіпоплазія емалі, множинний карієс. Інколи зуби взагалі не розвиваються. Відхилення зі сторони внутрішніх органів не спостерігались. Описані глухота, розщілина піднебіння, сірінгомієлія.
Відзначаються деякі зміни зі сторони тазового кільця – воно виглядає звуженим внаслідок недорозвитку поперекового відділу і кісток тазу. Іноді виявляють дефекти осифікації лонної і сідничної кісток. Часто відсутні медіальна частина верхньої гілки лобової кістки і гілки сідничної, що призводить до розширення епіфізу.
Порушення процесів осифікації проявляється іноді в множинних spina bifida від шийних до поперекових відділів хребта, в додаткових ядрах окостеніння поперечних відростків.
Дані обстежень:
Рентгенологічна картина черепно-ключичної дисплазії дуже характерна. Чим менша дитина, тим зміни в структурі черепа помітніші: брахіцефалія, кістки тонкі, шви розширені, в них додаткові кісткові вкраплення – вормієві кісточки. Провідний Rg-симптом – зміни в ключицях. Пренатальна УЗД можлива, адже ключиці плода легко помітні, але гіпоплазія і відсутність ключиць не патогномонічна для черепно-ключичної дисплазії, оскільки зустрічається і при інших захворюваннях.
Диференційний діагноз:
Диференційний діагноз проводять з:
- Травмою (переломом ключиці);
- Пікнодизостозом;
- Черепно-лицевим дизостозом.
Етіологія:
Захворювання успадковується за аутосомно-домінантним типом. Приблизно 1/3 всіх випадків являють собою свіжі мутації.
Частота: невідома.
Співвідношення статей: Ч1 : Ж1.
Лікування:
Лікування симптоматичне, в основному спостереження у стоматолога, іноді (при варусній деформації шийки стегна, вивиху плечового суглоба та сколіозі) – проведення ортопедичної корекції.
Прогноз:
Прогноз для життя сприятливий.
Номер з каталогу МІМ:
216330 Cleidocranial Dysplasia, Recessive Form.
Література:
- Козлова С.И., Демикова Н.С., Семанова Е., Блинникова О.Е. Наследственные синдромы и медико – генетическое консультирование.- М.: Практика,1996.- C. 312-313.
- Пренатальная диагностика врожденных пороков развития плода /Р. Ромеро, Дж. Пилу, Ф. Дженти и др.- М.: Медицина,1994.- С. 369-371.
- Jones KL. Smith’s Recognizable Patterns of Human Malformation. Philadelphia: W.B. Saunders Company, 1997:408.
- Warkany J. Congenital Malformations: Notes and Comments. Chicago: Year Book Publisher, 1981:836-840.
Переглянуто редакційною колегією I.B.I.S.: 31/05/2002
Фронтоназальна дисплазія
(Frontonasal Dysplasia)
Маргарита Іллівна Мегеден
Лікар-гінеколог
Рівненського обласного клінічного лікувально-діагностичного центру
Включення:
Синдром серединної розщілини обличчя; фронтоназальна мальформація (FNM).
Мінімальні діагностичні ознаки:
Істинний очний гіпертелоризм, широка основа носа, серединна щілина носа.
Клініка:
Типові гіпертелоризм і дефекти серединних структур черепа, що варіюють від прихованої розщілини лобної кістки черепа до мозкової кили. Відмічають клиноподібний ріст волосся на лобі (“мис вдови”).
Залежно від вираженості щілини кісток черепа розрізняють 3 форми дисплазії:
- Гіпертелоризм, широка основа і прихована щілина носа, іноді з роздвоєнням його кінчика.
- Гіпертелоризм, широка основа носа і відкрита щілина носа і серединна щілина верхньої губи. Можлива щілина піднебіння.
- Тотальна щілина носа, відсутність крил носа, деформація очниць.
У деяких випадках зустрічаються брахіцефалія, мікрофтальмія, епікант, епібульбарні дермоїди, колобоми райдужки, вроджена катаракта, колобоми верхньої повіки, преаурикулярні шкірні вирости, низько розташовані вушні раковини, глухота провідного типу, клинодактилія, крипторхізм, ліпоми лобної ділянки, переднє енцефалоцеле основи черепа.
Асоційовані аномалії:
Спостерігається поєднання фронтоназальної дисплазії з гідроцефалією, потиличним енцефалоцеле, голопрозенцефалією, ариненцефалією, мікрогірією, агенезією мозолистого тіла, краніосиностозом, мікропенісом, тетрадою Фалло, аплазією великогомілкової кістки, преаксіальною полідактилією ступнів. У 20% випадків спостерігається розумова відсталість середньої важкості. (Вказується на її залежність від наявності екстрацефальних аномалій або від ступеня вираженості гіпертелоризму).
Фронтоназальна дисплазія може бути ознакою синдромів множинних вроджених вад розвитку (МВВР).
Етіологія і патогенез:
Якщо носова капсула не розвивається нормально, то примітивний мозковий пухир займає простір, який в нормі належить капсулі, відповідно утворюючи закриту щілину черепа. Це призводить до морфокінетичної затримки орієнтації очей і порушення формування кінчика носа. “Мис вдови” утворюється внаслідок гіпертелоризму; виникають дві окремі ділянки, де ріст волосся пригнічений.
Варто відзначити, що частота народження близнюків у сім’ях з фронтоназальною дисплазією вища, ніж у загальній популяції. Досі не знайдено пояснення цього феномену.
Описані хромосомні аномалії при фронтоназальній дисплазії FNM: dup (2q) синдром, збалансована трансплантація t (15;22) (q22; q13), делеція 22q 11 тощо.
Пренатальна діагностика: можлива (УЗД).
Популяційна частота:
Популяційна частота важких форм від 1:80000 до 1:100000.
Діагностика:
Радіографічні ознаки: передня розщілина черепа, гіпоплазія фронтальних синусів, відсутність мозолистого тіла. При МРТ і КТ мозку знаходять кальцифікати серпа мозку і міжгемісферну ліпому в 50% випадків із вираженими аномаліями обличчя.
Співвідношення статей: Ч1 : Ж1.
Тип успадкування:
Невідомий. Більшість випадків спорадичні. Можливо мультифакторіальний.
Диференційний діагноз:
- Гіпертелоризм з аномалією стравоходу і гіпоспадією.
- Велике переднє енцефалоцеле.
- Лобна ліпома.
- Лобна тератома.
- Внутрішньочерепні кісти.
- Розщілина носа без гіпертелоризму.
- Окуло-аурикуло-вертебральний спектр.
- Фронто-фаціо-назальна дисплазія.
- Цефалополісиндактилія Грейга.
- Синдром Опітца.
- Синдром Sener.
- Акро-фронто-фаціо-назальний дизостоз.
- Синдром гіпертелоризму Тейбі.
- Синдром Аарскога.
- Синдром Ваарденбурга.
- Краніо-фронто-назальний синдром.
- Синдром Пея.
Номер з каталогу МІМ:
136760 Frontonasal Dysplasia.
Література:
- Наследственные синдромы и медико-генетическое консультирование /С.И. Козлова, Е.С. Семенова, И.С. Демикова, О.Е. Блинникова.- М.: Практика, 1996.- С. 281.
- Gorlin RJ, Cohen MM, Hennekam RCM. Syndromes of the Head and Neck. 4th edition. Oxford University Press 2001:977-981.
- Jones KL. Smith’s Recognizable Patterns of Human Malformations. 5th edition. W.B. Saunders Company. Philadelphia 1997:240-241.
Переглянуто редакційною колегією I.B.I.S.: 04/05/2005
Фіброзна дисплазія
(Fibrous Dysplasia)
Т.В. Краснопера
Спеціаліст з інформаційного забезпечення
Українсько-Американської Програми запобігання вродженим вадам розвитку
Що таке фіброзна дисплазія?
Фіброзна дисплазія – це хронічне захворювання скелету, що характеризується поодинокими або множинними вогнищами уражень, у яких нормальна кістка замінюється фіброзною тканиною.
Фіброзна остеодисплазія спричиняє нерівномірний ріст, ламкість та деформацію уражених кісток. Будь-яка кістка може бути охоплена процесом. У деяких пацієнтів хвора лише одна кістка (моноостотична фіброзна дисплазія), тоді як у інших – велика кількість кісток (поліостеотична фіброзна дисплазія). Найчастіше вражаються стегнові, велико-гомілкові, реберні, черепні кістки, кістки обличчя, плечові та тазові кістки, хребці ж, залучаються в процес набагато рідше. Хоча при фіброзній дисплазії патологічним процесом можуть бути охоплені декілька кісток, хвороба не переходить через суглоби з однієї кістки на іншу. Оскільки кістки черепа та тазу не відокремлені суглобами, фіброзна дисплазія може розповсюджуватися по черепу та тазу, так, ніби вони складаються з однієї кістки. Характерна однобічність уражень.
Як часто зустрічається фіброзна дисплазія і хто на неї хворіє?
Фіброзна дисплазія – відносно рідкісне захворювання, точні дані щодо його поширення, на жаль, відсутні. Хвороба розвивається у дитячому та молодому віці, не віддаючи переваги ані статі, ані належності до тієї чи іншої етнічної групи чи раси. Чим швидший її дебют, тим серйозніший прогноз.
Що спричиняє фіброзну дисплазію?
Клітини мають певні “рецептори”, здатні розпізнавати стимулюючі хімічні речовини, які виробляються іншими клітинами. Фіброзна дисплазія викликається аномальним хімічним “рецептором”, який називається Gs–альфа протеїн, в уражених клітинах, внаслідок чого відбувається постійна надлишкова стимуляція. Хімічні відхилення, зумовлені мутаціями гена, що відповідає за вироблення протеїну, виникають після зачаття на ранніх стадіях розвитку, і уражають лише клітини-потомки початково пошкодженої клітини. Таким чином, фіброзна дисплазія – вроджене захворювання, тобто, воно присутнє з народження, хоча проявитися може набагато пізніше.
Чи успадковується фіброзна дисплазія?
Ні. Фіброзна дисплазія не успадковується, і, як правило, не зустрічається у багатьох членів родини.
Які симптоми фіброзної дисплазії?
Найчастіше симптомами хвороби є біль у кістках, деформації та переломи кісток.
Біль у кістках. Біль у кістках виникає внаслідок поширення фіброзної тканини у кістці. Початок болю, особливо різкого та гострого, у кістці, значно ослабленій патологічним процесом, може свідчити про можливі переломи. Часом біль зумовлений тиском хворої кістки на розташований поруч нерв. У пацієнтів з ураженими стегновими чи гомілковими кістками, на які припадає вага тіла, може розвинутись артрит стегна чи коліна.
Деформація кісток. Деформація кісток може виникати у будь-якій ділянці скелету. Особливо помітні деформації на кістках черепа та обличчя. Фіброзна дисплазія черепа може спричинити втрату зору чи слуху.
Переломи. Поширюючись, фіброзна дисплазія захоплює прилеглу нормальну кістку, внаслідок чого та стає тонкою і крихкою, у ній легко трапляються переломи, особливо, це стосується довгих кісткок нижніх кінцівок, що несуть також найбільше статичне навантаження.
Як діагностується фіброзна дисплазія?
Кістки, уражені фіброзною дисплазією, зазвичай, мають характерний вигляд на рентгенівському знімку. Коли існує сумнів у правильності діагнозу, лікар може віддати зразок кістки для аналізу патогістологу. У деяких пацієнтів спостерігається підвищений рівень ферменту лужної фосфатази.
Що таке синдром Мак-К’юна–Олбрайта?
Якщо мутації Gs-альфа протеїну відбуваються на достатньо ранній стадії розвитку, то уражаються не лише кістки, а й інші тканини. Найчастіше це залози, які виробляють гормони (ендокринні) та пігментні клітини шкіри. Лікарі Донован Мак-К’юн та Фулер Олбрайт понад 50 років тому незалежно один від одного опублікували класичний опис синдрому, у якому фіброзна остеодисплазія розглядається разом з пігментними плямами шкіри (“плями кольору кави з молоком”) та гормональними розладами, особливо “передчасним статевим дозріванням”. Також було продемонстровано, що ця сама мутація Gs–альфа протеїну може вплинути на інші органи, включно із серцем. Термін “синдром Мак-К’юна–Олбрайта” використовується для позначення випадку фіброзної дисплазії із однією чи більше перерахованих рис. Між тим, протягом років, які пройшли з часу відкриття синдрому, було вивчено багато пацієнтів і з’ясувалося, що хвороба має досить широкий спектр проявів. Іноді діагноз ставиться в ранньому дитинстві хворим, із очевидними кістковими хворобами і помітно підвищеним рівнем гормонів залоз внутрішньої секреції; частина цих тяжко хворих померли. З іншого боку, багато дітей цілком здорові та мають нормальні перспективи в житті. Прояви кісткових чи ендокринних уражень у них слабкі, або зовсім відсутні, статеве дозрівання наступає близько до норми, а незвичайна пігментація і зовсім відсутня. У зв’язку з відзначеною різницею прояву хвороби у пацієнтів, різні компоненти цього складного синдрому розглядаються окремо у наступних розділах.
Симптоми гормональних розладів
Раннє (передчасне) статеве дозрівання. Якщо ознаки статевого дозрівання (розвиток грудей, яєчок, поява лобкового та під пахвами волосся, запах тіла, менструації та пришвидшений ріст) з’являються у дівчат до 8 років, а у хлопчиків до 9,5 років, то це називається передчасним статевим дозріванням. У найбільш загальній формі при передчасному статевому дозріванні рано активуються відділи мозку, які контролюють дозрівання гонад (яєчників у дівчат та яєчок у хлопчиків). Відділ мозку – гіпоталамус – виділяє речовину під назвою гонадоліберин або GnRH. Це в свою чергу впливає на інший відділ мозку – гіпофіз, що викликає підвищену секрецію гормонів, які називаються гонадотропінами (LH та FSH), які розносяться потоком крові та впливають на яєчники чи яєчки, стимулюючи виділення естрогену та тестостерону. Ендокринологи визначають, чи відбулася у дитини з передчасним статевим дозріванням рання активація гіпоталамуса та гіпофіза (гонадотропін-залежне передчасне дозрівання), шляхом вимірювання рівнів LH та FSH у крові після ін’єкції синтетичного препарату гонадоліберину GnRH.
Після вивчення багатьох дівчаток з синдромом Мак-К’юна–Олбрайта, виявилося, що у більшості рання активація гіпоталамуса та гіпофіза відсутня, тому що рівні LH та FSH у них зазвичай низькі, чи такі як у препубертатних дітей. Передчасне статеве дозрівання у цих дівчаток з синдромом Мак-К’юна–Олбрайта викликане естрогенами, які виділяються в кров кистами яєчників. Кісти можна побачити та виміряти при ультрасонографічному дослідженні. Вони можуть ставати доволі великими, іноді досягаючи розміру 50 кубічних сантиметрів (розмір м’яча для гольфу). Поява менструації та збільшення грудей супроводжуються ростом кист. По-суті, менструації до 2-річного віку були першими симптомами синдрому Мак-К’юна–Олбрайта в 85% випадків. Хоча кисти яєчників та нерегулярні менструації можуть бути наявні протягом підліткового та дорослого віку, багато жінок з синдромом можуть виношувати здорових дітей.
Передчасне статеве дозрівання при синдромі Мак-К’юна–Олбрайта важко лікувати. Після хірургічного видалення кист, або і всього ураженого яєчника, кисти знову з’являлися в іншому яєчнику. Гормональний препарат типу прогестерона Депо-ПРОВЕРА може призначатися для пригнічення місячних, проте він не сповільнює швидкість росту та розвиток кісток, і може мати негативний вплив на виділення адреналіну. Біосинтетичні форми GnRH (Деслорелін, Гістерелін та Люпрон) які пригнічують LH та FSH і використовуються при лікуванні звичайної гонадотропін–залежної форми передчасного статевого дозрівання, неефективні при наявності синдрому Мак-К’юна–Олбрайта. Клінічні випробовування проходить спосіб лікування з застосуванням препаратів, що блокують синтез естрогенів, (тестолактон і фадрозол), і в багатьох випадках підтверджена його ефективність.
Гіпертиреоз. Щитовидна залоза регулює обмін речовин і є важливою для нормального фізичного і розумового розвитку. Коли ця залоза функціонує занадто активно, людина страждає на гіпертиреоз. Ознаками гіпертиреозу є підвищена збудливість, надмірне потіння та втрата ваги. При синдромі Мак-К’юна–Олбрайта проблема спричинена гіперактивними вузлуватими потовщеннями в щитовидній залозі. Близько 50% пацієнтів із синдромом Мак-К’юна–Олбрайта мають порушення щитовидної залози, включно із загальним збільшенням, яке називають зоб, та вузлуваті потовщення і кисти. У деяких пацієнтів ледь помітні структурні зміни виявляються лише ультрасонографічно. Гіпофізарні рівні гонадоліберину у цих пацієнтів низькі, а рівень гормонів щитовидної залози може бути нормальним чи підвищеним. Занадто високий рівень гормонів щитовидної залози потребує застосування препаратів, які блокують виділення цих гормонів.
Підвищена активність надниркових залоз. Надниркові залози – дві ендокринні залози, розташовані якраз над нирками, що допомагають регулювати використання організмом вуглеводів, жирів та білків, а також контролювати реакцію організму на стрес. Ознаками підвищеної активності надниркових залоз є зростання ваги, почервоніння обличчя, м’язова слабкість та високий рівень цукру крові.
Надлишкове виділення гормону гіпофізу. Гіпофіз, розташований в основі черепа під відділом мозку, який називається гіпоталамус, є найважливішою ендокринною залозою в організмі. Він не тільки контролює інші залози внутрішньої секреції, такі як щитовидна і надниркові залози, але також важливий для інших функцій організму. Ознаками надлишкової секреції гормону гіпофізу можуть бути:
- вироблення молока у грудях жінок, які не були нещодавно вагітними. Це сигналізує про надлишкове виділення гормону пролактину;
- гігантизм (надзвичайно високий зріст). Цей стан є результатом надлишкового виділення гормону росту, яке почалося до статевої зрілості;
- акромегалія (збільшення окремих ділянок тіла) виникає внаслідок надлишкового рівня гормону росту після статевого дозрівання (коли основні зони росту кісток вже закриті);
У декількох пацієнтів із синдромом Мак-К’юна–Олбрайта спостерігалося надлишкове виділення гіпофізарного гормону росту. Більшості діагноз було встановлено у віці від 18-21 року, коли у них грубшали риси обличчя, збільшувалися розміри кінцівок, з’являвся артрит, характерний для стану під назвою акромегалія. Терапія включала хірургічне видалення тієї частини гіпофізу, яка виділяла цей гормон, і використання нового синтетичного аналога гормону соматостатину, який пригнічує виділення гормону.
Високий рівень кальцію крові (гіперкальціємія) у зв’язку з надмірною активністю паращитовидних залоз. Паращитовидні залози, розташовані біля щитовидної залози, контролюють метаболізм кальцію в організмі. Ознаками високого вмісту кальцію в крові, викликаного надмірною секрецією гормону паращитовидних залоз, можуть бути нудота, блювання, запор та сповільнення розумових функцій.
Рахіт. У цьому стані кістки занадто м’які у зв’язку з нестачею кальцію та фосфатів. М’які кістки згинаються під вагою тіла. У окремих випадках у дітей з фіброзною дисплазією при рахіті спостерігається затримка росту і деформується скелет. Коли так трапляється, це пов’язано з надмірним виділенням фосфатів з сечею. Нестача вітаміну Д також може викликати подібний стан.
Пігментація шкіри. Пацієнти зі синдромом Мак-К’юна–Олбрайта можуть мати одну або декілька уражених ділянок на шкірі, що представлені плямами з нерівними контурами та дещо темнішою пігментацією (“кольору кави з молоком”), ніж шкіра пацієнта. Їх часто називають “родимками”.
Чому у деяких пацієнтів з фіброзною дисплазією розвиваються гормональні проблеми, а у інших – ні?
Вище було продемонстровано, що зміни хімізму Gs-альфа протеїну однотипні в кістках, уражених фіброзною дисплазією, та в ендокринних залозах пацієнтів, що зумовлює надлишкову секрецію гормонів. Наприклад, якщо мутації трапляються у щитовидній залозі, то результатом буде гіпертиреоз.
Які методи лікування фіброзної дисплазії існують?
Хірургічне втручання. Хірургічне втручання рекомендується для полегшення хронічного кісткового болю, покращення рухливості (погіршеної у зв’язку з деформацією скелету), запобігання переломів, зменшення тиску на спинний мозок, спинномозкові нерви чи мозок, а також для лікування ускладнення – саркоми кістки. Хірургічні процедури, які використовуються, це:
- видалення ураженої кістки і пересадка здорової у пацієнтів з хронічними кістковими болями;
- видалення частини кістки, розташування там нагелів або штифтів і пересадка здорової кістки для виправлення деформацій.
Медикаментозне лікування. Памідронат (Аредія®) – це препарат, який контролює процес руйнування кістки спеціальними клітинами – остеокластами. Він затверджений Управлінням по контролю за продуктами та ліками США для застосування у пацієнтів, що страждають від певних пухлин з ураженням кісток (рак грудей, мієлома), для лікування високого рівню кальцію крові, пов’язаного з раком, і для пацієнтів із хворобою Педжета. У цьому відношенні фіброзна дисплазія поводиться, як пухлина. При всіх цих хворобах, включно із фіброзною дисплазією, остеокласти руйнують нормальну кістку. Памідронат (Аредія®) “вимикає” остеокласти, блокуючи захоплення неураженої кістки. Результати, отримані з декількох медичних центрів, свідчать, що регулярний прийом памідронату (Аредія®) може запобігти або відчутно сповільнити захоплення прилеглої неураженої кістки фіброзною дисплазією зі значним полегшенням болю у багатьох пацієнтів. Покращення, помітні на рентгенівському знімку у кількох випадках, свідчать, що при лікуванні памідронатом (Аредія®) можливе певне відновлення кістки.
Які лікарі спеціалізуються на діагностиці та лікуванні фіброзної дисплазії?
Зазвичай пацієнтів з фіброзною дисплазією оглядають і лікують хірурги–ортопеди, оскільки більшість симптоматичних хворих страждають від болей та деформації скелету. Допомога пластичних хірургів необхідна для виправлення деформацій обличчя, нейрохірургів – для лікування мозкових чи спинномозкових ускладнень. Кісткові пухлини лікують хірурги–ортопеди, яких спеціально навчали для оперативного лікування пухлин кістки. Пацієнтів з гормональними проблемами найкраще лікують ендокринологи. Лікарі, які спеціалізуються на лікуванні кісткових та мінеральних розладів, будуть найбільш досвідченими у медикаментозних аспектах лікування фіброзної дисплазії, таких як використання памідронату.
Які прогнози для хворих на фіброзну дисплазію?
Прогноз для хворих на фіброзну дисплазію залежить від важкості захворювання. У молодих пацієнтів з великою кількістю уражених кісток ускладнень може виникнути більше, ніж у інших пацієнтів. У пацієнтів з одним-двома ураженими ділянками шкіри симптоми можуть бути помірними, або й зовсім відсутніми. Гормональні розлади, зазвичай, успішно лікуються, як тільки встановлено діагноз. Фіброзна дисплазія рідко призводить до смерті пацієнта. Злоякісні пухлини розвиваються рідко.
Наразі встановити діагноз до народження дитини неможливо, як і передбачити точно, наскільки важка форма захворювання буде в ураженої дитини. Немає описаних випадків синдрому в батьків хворих дітей, так само, як діти жінок зі синдромом Мак-К’юна–Олбрайта – здорові. Частота захворювання у представників різних рас не відрізняється.
Чи рекомендовані фізичні вправи хворим на фіброзну дисплазію?
Фізичні вправи є дуже важливими для підтримки здоров’я скелету; вони допомагають запобігти зростанню ваги та зберегти рухливість суглобів. Хоча фізичні вправи і рекомендовані пацієнтам з фіброзною дисплазією, програма занять повинна бути ретельно розроблена під наглядом лікаря, щоб звести до мінімуму ризик переломів.
Переглянуто редакційною колегією I.B.I.S.: 26/03/2003
Танатоформна дисплазія (ТД)
(Thanatophoric Dysplasia)
О. Голуб
Лікар–гінеколог
Рівненської обласної лікарні
Включення:
Танатоформна карликовість.
Основні діагностичні критерії:
Танатоформна дисплазія являє собою летальну форму скелетної дисплазії, яка характеризується вираженою ризомелією, викривленням трубчастих кісток, нормальною довжиною тулуба, вузькою грудною кліткою і відносно великим розміром голови (мегаленцефалія).
Виділяють 2 типи хвороби. Тип 1 (ТД І) більш генералізований і характеризується викривленням довгих кісток і дуже пласкими тілами хребців. Тип ІІ (ТД ІІ) характеризується прямим стегном і тонкими хребцями. Більшість випадків ТД ІІ мали дуже виражений “череп у формі трилисника”.
Частота:
0,69 на 10000 новонароджених. Танатофорна дисплазія відноситься до форм скелетних дисплазій, які найбільш часто зустрічаються.
Етіологія:
Аутосомно-домінантний ген, переважно – результат нових мутацій. Більше 50% пацієнтів з типом І танатофорної дисплазії (ТД І) і 100% з типом ІІ танатофорної дисплазії (ТД ІІ) мали мутації гена рецептора 3 фактору росту фібробластів (FGFR3). ТД І асоціюється з мутацією екстра целюлярного домену FGFR3, а ТД ІІ – з мутацією інтрацелюлярного домену тирозинкінази.
Клінічна картина:
Виражене ризомелічне вкорочення кінцівок. Стегнові кістки різко вкорочені і викривлені, при найбільш важких формах захворювання вони можуть мати форму телефонної трубки. Грудна клітка звужена в передньо – задньому напрямку, ребра вкорочені. Порушення дихання. Тулуб нормальної довжини. Тіла хребців сплющені, розширені міжхребцеві простори, що призводить до появи характерної рентгенологічної ознаки: літери “Н”. Основа черепа вкорочена, великий потиличний отвір часто зменшений в розмірах. Лоб випуклий, можуть відмічатись гіпертелоризм і сідлоподібний ніс. Поверхні підошов та долонь не змінені, але пальці короткі, “сосископодібні”. Малогомілкові кістки коротші, ніж великогомілкові.
Танатофорна дисплазія являє собою тип порушення процесу ендохондрального окостеніння з вираженим порушенням гістологічної картини ростової пластинки: зменшення або повна відсутність проліферації і дозрівання хондроцитів, які не сформовані в колони, а розташовані хаотично. Кісткові трабекули орієнтовані вертикально і горизонтально (в нормі трабекули повинні бути орієнтовані тільки вертикально). У хондроцитах можуть з’явитись метахроматичні включення.
Поєднані аномалії:
Танатофорна дисплазія у 14% випадків поєднується з певною формою краніосиностозу, яка називається черепом у формі трилисника. Ця аномалія зумовлена передчасним закриттям вінцевого та лямбдоподібного швів. На фоні гідроцефалії ростральне розширення кори та шлуночкової системи призводить до збільшення переднього тім’ячка, розділення та стиснення скроневих кісток. Термін “трилисник” зумовлений трьома “листками”, які утворюються випуклістю черепа всередині і двома висковими кістками по боках. Механізм утворення цієї аномалії поки що недостатньо зрозумілий. Вважається, що в основі патогенезу “трилисника” лежить дефект процесу ендохондральної осифікації, внаслідок якої передчасно утворюються синостози деяких швів.
Повідомлялось також про поєднання захворювання з підковоподібною деформацією нирок, гідронефрозом, дефектом міжпередсердної перетинки, вадою тристулкового клапана, атрезією ануса і променево-ліктьовим синостозом, відкритою артеріальною протокою. Нерозвинуті нижні оливи і зубасті ядра мозочка.
Діагноз:
Кістки кінцівок дуже короткі. Хребці сильно зменшені у висоті. Розширений міжхребцевий простір. Безпричинне звуження спинного каналу. У фронтальній проекції хребці мають форму Н. Стегна мають форму телефонної трубки.
Пренатальна діагностика:
За допомогою ехографії антенатальний діагноз може бути поставлений при виявлені ознак карликовості з укороченням кінцівок, гіпопластичності грудної клітки і черепа у формі трилисника. Крім того може бути виступаючий лоб. Викривлення стегнової кістки, вузька грудна клітка, великі розміри голови навіть при звичайних розмірах шлуночків та кількості м’яких тканин стають більш вираженим по мірі росту та розвитку плоду, але можуть бути відсутніми в другому триместрі вагітності. У 71% випадків танатофорна дисплазія поєднується з багатовіддям, яке буває настільки вираженим, що може стати причиною передчасних пологів. Рухова активність плоду, очевидно, не страждає при цьому захворюванні, але повідомляється про її зниження в третьому триместрі вагітності. Встановлення точного діагнозу танатофорної дисплазії, напевно, можливе в тих випадках, коли різко виражена мікромелія поєднується з черепом у формі трилисника. При відсутності типових змін черепа (“трилисник”) підозра на захворювання повинна виникати, якщо є різко виражена ризомелічна карликовість на тлі вузької грудної клітки.
Диференційний діагноз:
Диференційний діагноз слід проводити з синдромом Елліса-Ван Кревельда (хондроектодермальна дисплазія), асфіксичною дисплазією грудної клітки, синдромом хондродисплазії з полідактилією та гомозиготною ахондроплазією.
Гомозиготна ахондроплазія може бути віддиференційована, оскільки це аутосомно-домінантне захворювання, а тому обидва батьки страждають на нього. При гетерозиготній формі трубчасті кістки лише злегка вкорочені і не викривлені. Співвідношення між довжиною стегнової кістки і біпар’єтальним розміром стає аномальним після 21-27 тижня вагітності. При танатофорній дисплазії мікромелія, навпаки, може бути настільки виражена, що виявляється в деяких випадках уже на 19 тижні вагітності.
Асфіксична дисплазія грудної клітки може бути віддиференційована по менш вираженому вкороченню кісток і збереженню тіл хребців. Пренатальне рентгенологічне дослідження хребта плода допомагає в діагностиці. Ультразвукове обстеження в реальному масштабі часу може бути використане для вибору правильної площини рентгенологічного дослідження хребта. Танатофорна дисплазія характеризується Н-подібною конфігурацією тіл хребців.
Для хондроектодермальної дисплазії типові правильно сформований зайвий палець і вкорочення кінцівки по акромелічному типу. Фіброхондрогенез характеризується гантелеподібними метафізами.
Прогноз:
Захворювання закінчується летально. Смерть наступає незабаром після народження. Причиною смерті є серцево-судинна і дихальна недостатність, що пов’язано, напевно, зі зменшенням об’єму грудної клітки. У тих дітей, що змогли пережити неонатальний період, спостерігались виражена затримка зросту і психомоторного розвитку.
Акушерська тактика:
При достовірному діагнозі переривання вагітності слід пропонувати при будь-якому її терміні, оскільки захворювання летальне. Гідроцефалія на фоні зміненого у вигляді трилисника черепа може призвести до формування клінічно-вузького тазу. У цьому випадку при родорозрішенні рекомендовано цефалоцентез.
Тип успадкування:
Зазвичай, аутосомно-домінантний. Хоча, бувають випадки і аутосомно-рецесивних випадків.
Номер з каталогу МІМ:
187600 Thanatophoric Dysplasia; TD
Література:
- Тератология человека /Под ред. Г.И. Лазюка.- М.: Медицина, 1979.- C. 357-359.
- Jones KL. Smith’s recognizable Patterns of Human Malformation. Philadelphia: W.B. Saunders Company 1997:338-339.
- Warkany J. Congenital Malformations. Notes and Comments. Chicago: Year Book Publisher 1981:768–781.







