Сучасна стратегія пренатальної діагностики на ранніх термінах вагітності
(Prenatal Diagnosis in Early Pregnancy)
Зоряна Олексіївна Сосинюк
завідуюча відділенням пренатальної ультразвукової діагностики
Рівненського обласного медико-генетичного центру
Народження хворої дитини пов’язане з важким моральним та матеріальним тягарем як для сім’ї, так і для суспільства. Тому пренатальне виявлення вродженої і спадкової патології продовжує залишатися одним з найактуальніших питань охорони здоров’я. Спеціалісти в галузі допологової діагностики все частіше намагаються перенести обстеження на більш ранні терміни вагітності. Це пояснюється, насамперед, бажанням лікаря раніше виявити патологію, прийняти правильне рішення щодо подальшого супроводу вагітності.
Застосування новітніх технологій, розвиток діагностичної апаратури дозволяють досягти значних успіхів в ранньому виявленні захворювань у плода, використовуючи нові ультразвукові маркери. Розробка та впровадження в практику охорони здоров’я пренатальних скринінгових програм надає можливість не тільки діагностувати патологічний перебіг вагітності, але і формувати групи високого ризику з виникнення хромосомних аномалій у плода.
|
Оптимальним для ехографії в першому триместрі вважається термін вагітності, коли інформація про розвиток ембріона буде максимально повною і точною.
З практики добре відомо що візуалізація плідного мішечка можлива з початку п’ятого тижня вагітності (від першого дня останньої менструації) або з початку третього тижня від моменту запліднення, тобто фактично на стадії імплантації плідного мішечка в ендометрій. Ультразвукове обстеження, проведене на цьому етапі, лише констатує наявність вагітності в порожнині матки чи поза нею, але практично не дає інформації про ембріон.
З початком реєстрації серцевої діяльності ембріона (шостий тиждень від першого дня останньої менструації) при ультразвуковому дослідженні можна достовірно судити про характер вагітності (вагітність розвивається чи завмерла), але анатомія ембріона і в цьому терміні залишається невідомою.
В першому триместрі вагітності не існує магічного терміну найкращої оцінки структур плода. Період ембріогенезу (початок п’ятого – кінець десятого тижня від першого дня останньої менструації) характеризується надзвичайною динамічністю. Відмінною особливістю соноембріології є безперервні якісні морфологічні зміни анатомічних утворів ембріона, активний його ріст. Ехографічне зображення щоденно змінюється. Очевидно, що в цих умовах неможливо проводити ефективну діагностику вад розвитку.
На межі 10-11 тижня від першого дня останньої менструації закінчується формування внутрішніх органів. Після періоду ембріогенезу настає плодовий період розвитку, який характеризується “дозріванням” внутрішніх органів і збільшенням їх розмірів. Незважаючи на те, що після десятого тижня нові анатомічні структури вже не виникають, при проведенні ультразвукового обстеження в ранні терміни (до 14 тижнів) можна в кращому випадку констатувати лише наявність того чи іншого органу, але не оцінювати його будову у зв’язку з його невеликими розмірами.
Приведені вище дані свідчать про те, що більшість органів і систем плода стають більш доступні для візуалізації лише після 12 тижня вагітності. Так, класичне зображення “метелика” при оцінці структур головного мозку можна отримати не раніше 12-13 тижня, зображення дрібних деталей обличчя – після 14-го тижня. Стабільно візуалізувати чотирьохкамерний зріз серця, нирки, сечовий міхур можна з 12-13 тижня, шлунок – не раніше 10-11 тижня і т.д. Слід підкреслити, що мова йде не про ексклюзивні дослідження, а про традиційну ехографію доступну всім вагітним, яку проводять в практичній охороні здоров’я на ультразвукових апаратах середнього класу.
На першому етапі скринінгу мова йде про виявлення лише грубих аномалій розвитку, а не про реальний скринінг вроджених вад розвитку. Більшість вад розвитку на цьому етапі або зовсім недоступні для візуалізації, або потребують підтвердження в більш пізні терміни.
Взаємозв’язок між ВВР плода і терміном її виявлення
(трансабдомінальне сканування)
Аненцефалія. Екзенцефалія. Ініонцефалія |
||||
Неможливість адекватної і надійної оцінки анатомії плода до 12 тижнів та здійснення верифікації діагнозу дозволяє зробити висновок про те, що діагностика вроджених вад розвитку плода не є основною метою першого скринінгового обстеження. Виявлення аномалій розвитку лише доповнення до головного завдання першого етапу скрінінгу – формування серед вагітних групи ризику виникнення вроджених вад розвитку у плода.
|
Одним з відносно нових і універсальних ехографічних маркерів хромосомних аномалій є товщина комірцевого простору. Перші публікації з’явилися в 1992 році, а на IV Всесвітньому конгресі з ультразвукової діагностики в акушерстві та гінекології, який відбувся в жовтні 1994 року в Будапешті був прийнятий термін “nuchal translucency” (“комірцевий простір”) в якості уніфікованої назви цього маркеру. Сьогодні в 43 країнах світу оцінка товщини комірцевого простору у плода використовується при скринінговому ультразвуковому обстеженні в 10-14 тижнів вагітності. Чіткий зв’язок між збільшенням цього параметру і хромосомними абераціями, а також окремими формами вроджених вад розвитку дозволяє виділяти із загального потоку вагітних тих пацієнток, які потребують пренатальної інвазивної діагностики і динамічного контролю.
Товщина комірцевого простору – це ділянка між внутрішньою поверхнею шкіри плоду і зовнішньою поверхнею м’яких тканин в проекції шийного відділу хребта. Для підвищення ефективності скрінінгового обстеження необхідно дотримуватися таких правил:
- оцінка товщини комірцевого простору проводиться в 10-14 тижнів вагітності при числових значеннях куприково-тім’яного розміру плода від 35 до 85 мм;
- вимірювання товщини комірцевого простору здійснюється в сагітальній площині сканування.
Шийна ділянка плода візуалізується при трансабдомінальному обстеженні і є доступною для вимірювання в 95% спостережень. Трансвагінальний доступ для вимірювання слід використовувати лише у випадках, коли оцінка структур плоду затруднена.
|
Частота виявлення розширенного комірцевого простору у плода коливається від 0,5 до 6%. Частота виявлення хромосомних аберацій у плодів з цим ехомаркером в терміні 10-14 тижнів вагітності варіює від 24 до 75% і тому є показом до пренатального каріотипування. При товщині комірцевого простору більше 2,5 мм ризик хромосомних аномалій у плода підвищується в 23,8 рази. Зі збільшенням товщини комірцевого простору зростає частота виявлення хромосомних аномалій, в той же час як при товщині комірцевого простору менше 2,5 мм фактичний ризик трисомії у жінок 35 років і старше нижчий від вікового.
За останні роки в літературі були опубліковані дані про те, що розширення комірцевого простору може відмічатися не лише при хромосомних дефектах у плода, але і при вадах розвитку, діагностика яких потенційно можлива в більш пізні терміни вагітності, зокрема, вроджених вад серця. Враховуючи те, що в ході пренатального скринінгового обстеження діагностується не більше 30% грубих вад серця, проведення цілеспрямованого ехокардіографічного дослідження в 20-24 тижні у плодів, які мали розширенний комірцевий простір в 10-14 тижнів, дозволить значно підвищити діагностику серцевих аномалій.
Частота хромосомних аномалій і вроджених вад серця у плодів
в залежності від товщини комірцевого простору
Особливість візуалізації комірцевого простору (поява не раніше 10 і зникнення після 14 тижня від першого дня останньої менструації) свідчить про транзиторний характер ехомаркеру, що визначає в даному випадку термін проведення першого етапу скринінгу – 10-14 тижнів.
Підвищення ефективності скринінгового обстеження в першому триместрі вагітності можна досягти шляхом розрахунку комбінованого ризику за даними товщини комірцевого простору в поєднанні з даними біохімічного скринінгу. З одного боку він підвищує ефективність ультразвукового скринінгу, а з іншого дозволяє оцінити ризик народження дитини з хромосомною патологією, здійснити диференційований підхід до призначення інвазивних досліджень як молодим матерям, так і жінкам старшої вікової групи.
Найбільш розповсюдженим лабораторним обстеженням в першому триместрі вагітності є визначення двох біохімічних маркерів: бета-субодиниці хоріонічного гонадотропіну (ХГ) та асоційованого з вагітністю плазменного протеїну А (РАРР-А). Хоріонічний гонадотропін з’являється в материнському кровотоці після імплантації ембріона. Його рівень підвищується до 8-го тижня гестації. В нормі з 8-го по 12–ий тиждень вагітності рівень ХГ починає незначно, а з 18-го тижня – значно знижуватися. Рівень ХГ залежить від маси тіла вагітної. Концентрація його знижується із зростанням ваги. При багатоплідній вагітності показники збільшуються вдвічі і більше.
В 1987 році Bogart M.H. і співавторами доведено, що підвищення рівня ХГ в материнській крові часто зустрічається при хромосомній патології плода (зокрема, при хворобі Дауна). Таким чином, ХГ був віднесенний до біохімічних маркерів хромосомних захворювань. Так, при трисомії 13 рівень бета-субодиниці ХГ підвищується, а при трисомії 18, може різко знижуватися.
В 1991 році Brambati B. і співавторами доведено, що асоційований з вагітністю плазменний протеїн А (РАРР-А), який виробляється трофобластом і з’являється в материнській крові на 28-ий день гестації, знижений в першому триместрі вагітності при синдромі Дауна та при інших хромосомних аномаліях плода. З’ясувалось, що найбільш оптимальним терміном для визначення РАРР-А є період з 10 по 12 тиждень вагітності, коли його вміст в материнській крові при трисомії 21 падає більше, ніж у два рази. Ступінь значущості діагностики хромосомної патології при використанні тільки одного маркера складає 42%. Використання обох маркерів (ХГ і РАРР-А) підвищує можливість діагностики хромосомних аберацій до 60%. З врахуванням віку матері, ефективність діагностики зростає до 75%.
Чутливість методу (%) в залежності від комбінації факторів
Вік – 14-22 (30%).
Вік, альфафетопротеїн (AFP) – 14-22 (37%).
Вік, альфафетопротеїн (AFP), хоріонічний гонадотропін (ХГ) – 14-22 (59%).
Вік, альфафетопротеїн (AFP), хоріонічний гонадотропін (ХГ), некон’югований естріол – 14-22 (69%).
Вік, альфафетопротеїн (AFP), хоріонічний гонадотропін (ХГ), некон’югований естріол, інгібін А – 14-22 (76%).
Вік, комірцевий простір (NT), хоріонічний гонадотропін (ХГ), плазмений протеїн А (PAPP – A) – 11-13 (80-90%).
Крім того, десятки публікацій останніх років показали, що застосування імунобіохімічних маркерів та ультразвукового вимірювання товщини комірцевого простору у плода підвищують діагностичну точність такого підходу, сумарна чутливість якого з індивідуальним врахуванням фактору віку матері, перевищує 90%.
Ризик народження дитини з синдромом Дауна
Після отримання результатів всіх обстежень для кожної жінки з допомогою комп’ютерної програми розраховується індивідуальний комбінований ризик народження дитини з хромосомною патологією. Якщо у вагітної цей ризик перевищує порогове значення (1:250), жінка потрапляє до групи високого генетичного ризику і їй рекомендується проведення інвазивних процедур (в першому триместрі вагітності – біопсія хоріону, в другому триместрі – амніоцентез з метою визначення каріотипу плоду).
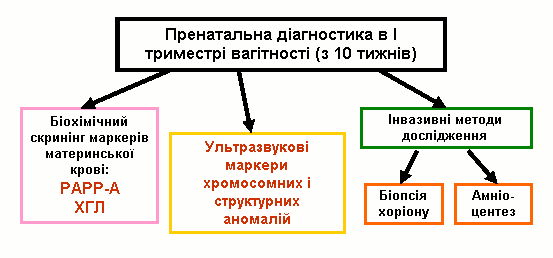
Комплексна пренатальна діагностика в першому триместрі вагітності має очевидні переваги для пацієнтів та клініцистів:
- Формування “групи ризику” серед вагітних щодо вроджених вад розвитку плоду.
- Зменшення кількості інвазивних процедур.
- Зменшення кількості ускладнень інвазивних втручань (“спровоковані викидні“).
- Зменшення вартості допологової діагностики.
Список літератури:
- Бахарев В.А., Каретникова Н.А., Полестеров Ю.А. и др. Значение ранннего амниоцентеза для пренатальной диагностики в І триместре беременности //Акушерство и гинекология.- 1991.- № 4.- С. 9-10.
- Медведев М.В., Алтынник Н.А. Воротниковое пространство у плодов в ранние сроки беременности: новые аспекты пренатальной диагностики //Ультразвуковая діагностика в акушерстве, гинекологии и педиатрии.- 1999.- Т. 7, № 1.- С. 19-26.
- Медведев М.В., Мальмберг О.Л. Новые пренатальные эхографические маркеры хромосомной патологии //Ультразвуковая диагностика в акушерстве, гинекологии и педиатрии.- 1995.- № 1.- С. 13-21.
- Пренатальная диагностика врожденных пороков развития в ранние сроки беременности /Под ред. М.В. Медведєва.- М.: Реальное время, 2000.- 160 с.
- Снайдерс Р.Дж.М., Никалаидес К.Х. Ультразвуковые маркеры хромосомных дефектов плода.- М.: Видар, 1997.- 92 с.
- Юдина Е.В., Медведев М.В. Дородовая диагностика синдрома Дауна в России в 2005 году, или Перинатальная драма в трех частях с прологом и эпилогом //Журнал “Пренатальная диагностика”.- 2007.- № 4.- С.252-257.
- Cucle HS,Van Lith JMM. Appropriate biochemical parameters in first-trimester screening for Down syndrome. Prenat Diagn 1999;19:505-512.
- Nicolaides KH, Sebire NJ, Snijders JM. The 11-14 week scan: The diagnosis of fetal abnormalities. NY, L.The Parthenon Publ. Gr. 1999.







