Загальний артеріальний стовбур
(Common Truncus Arteriosus)
В.П. Вернидуб
Заступник головного лікаря з лікувальної роботи
Хмельницької обласної дитячої лікарні
Загальний артеріальний стовбур – вроджена вада серця, при якій від цибулини серця відходить одна велика судина через єдиний півмісяцевий клапан і яка забезпечує коронарний, легеневий та системний кровообіг. Разом із транспозицією магістральних судин подвійне відходження магістральних судин представляє групу конотрункальних аномалій серця.
Синоніми: коно-трунко-фаціальний синдром, CAFS.
Включення:
Загальний стовбур, загальний аортопульмональний стовбур, персистуючий артеріальний стовбур.
Виключення:
Загальний артеріальний стовбур у пацієнтів, як прояв делеції 22q11 (синдром Ді-Джорджі, вело-кардіо-фаціальний синдром).
Етіологія:
Ген CFC1, локалізований на 22q11.2, вважають геном-кандидатом конотрункальних аномалій серця. Загальний артеріальний стовбур може бути складовою частиною синдромів, що пов’язані з делецією 22q11 (синдром Ді-Джорджі (188400), вело-кардіо-фаціальний синдром (192430), геніто-палато-кардіальний синдром (231060). Із використанням FISH встановлено гомозиготність регіону 22q11.2 у 98% пацієнтів із загальним артеріальним стовбуром.
У 12,7% – 30% випадків ізольованих коно-трункальних аномалій за даними різних авторів виявлено мікроделеції 22q11.2.
Враховуючи специфічні характерологічні риси у пацієнтів із вело-кардіо-фаціальним синдромом, підвищену частоту психозів шизофреноїдного кола у родинах пробандів, висловлюється припущення про локалізацію гена, що зумовлює схильність до шизофренії, на 22q11.
Описані випадки загального артеріального стовбура у новонароджених із вродженою краснухою.
Ембріогенез:
Дана аномалія зумовлена порушенням поділу артеріального стовбура на головні магістральні артерії.
Конус сполучається з середньою третиною цибулини серця. Він дає початок вихідним трактам обох шлуночків та їх м’язевій частині, розташованій між атріовентрикулярними та півмісяцевими клапанами. Частина конуса бере участь в утворенні стінок шлуночків (парістальний конус), інша частина – в розвитку перетинки (кональна перетинка).
Конус представляє собою дистальну частину цибулини серця. У процесі ротації і внутрішньої септації утворюються півмісяцеві клапани та дві головні артерії. Розподіл аорти і легеневих артерій відбувається шляхом злиття стовбурових гребенів. Конотрункальний поділ відбувається між 6-им і 7–им тижнями ембріонального розвитку. Розвиток дуги аорти розпочинається на 4-му тижні і на 6-му тижні формується сполучення її з серцем.
Припинення тимчасового взаєморозміщення цих двох трактів пояснює часте поєднання загального артеріального стовбура з аномаліями дуги аорти, які зустрічаються у 20% випадків.
Патологічна анатомія:
Анатомічними критеріями загального артеріального стовбура є: відходження від цибулини серця однієї судини, яка забезпечує системний, коронарний та легеневий кровообіг; легеневі артерії відходять від висхідної частини стовбура; існує єдине клапанне кільце стовбура. Термін “псевдотрункус“ відноситься до аномалій, при яких легенева артерія або аорта атрезовані і представлені фіброзними пучками.
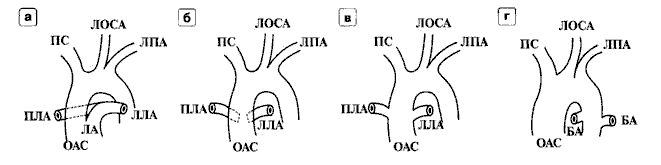
Мал. 1 Схема анатомiчних варіантів ОАС. а – I тип, б – II тип, в – III тип, г – IV тип. БА – бронхіальні артерії.
(Coollet R.W., Edwards J.E. Persistent trancus arteriosus: classification according to anatomic types.
Surg Clin North Am 1949;29:1245.)
R.W. Collett і J.E. Edwards виділяють 4 типи загального артеріального стовбура (див. Мал.1):
- Від загального артеріального стовбура відходять єдиний стовбур легеневої артерії, який ділиться на дві гілки – праву і ліву та висхідну аорту. Довжина загального артеріального стовбура складає 0,4-2,0 см.
- Від задньої стінки загального артеріального стовбура відходять самостійно дві легеневі артерії. Довжина легеневої артерії становить 2-8 мм.
- Легеневі артерії відходять окремо від латеральних стінок трункуса, гіпоплазовані.
- Повна відсутність легеневих судин. Кров надходить від коллатералей системних і бронхіальних артерій, що мають початок у нисхідній дузі аорти.
Клапан загального артеріального стовбура може бути одно- (4%), двох- (32%), трьох- (49%) і чотирьохстулковим (15%). Стулки можуть бути нормальними, потовщеними (22%), диспластичними (50%). Така будова стулок сприяє виникненню клапанної недостатності. Стулки клапана загального стовбура фіброзно пов’язані з мітральним клапаном, тому вважається, що він в основному аортальний.
Дефект міжшлуночкової перетинки є органічною частиною загального артеріального стовбура, він не має верхнього краю, лежить безпосередньо під клапанами і зливається із вустям стовбура, інфундибулярна перетинка при цьому відсутня. Загальний артеріальний стовбур по відношенню до дефекту розміщується у 42% випадків над обома шлуночками, у 42% – переважно над правим шлуночком і в 16% – над лівим.
Гемодинаміка:
Значних гемодинамічних змін при нормальній функції клапана загального артеріального стовбура у плода не відбувається, оскільки в порожнинах серця відбувається змішування артеріальної та венозної крові і серце працює як єдина камера. Наявність ознак серцевої недостатності свідчить про порушення функції клапанного кільця трункуса, виражену його недостатність.
При відсутності звуження вустя легеневої артерії або її гілок виникають виражені гемодинамічні порушення відразу після народження. У порожнинах серця, аорті та легеневій артерії підтримується однаковий тиск, що приводить до переповнення кров’ю легеневих судин, розвитку серцевої недостатності, яка є причиною смерті хворих. Наявність недостатності клапанного апарату збільшує прояви серцевої недостатності. Рано розвивається легенева гіпертензія.
Звуження устя легеневої артерії вберігає мале коло від перевантаження об’ємом і створює градієнт тиску між аортою та стовбуром легеневої артерії. При цьому виникає серцева недостатність обох шлуночків: лівого – через велике повернення крові, правого – через високий системний тиск.
Клінічні прояви та діагностика:
Клінічні прояви залежать від гемодинаміки. Стан новонароджених вкрай важкий з перших хвилин життя, особливо при відсутності звуження на рівні устя легеневої артерії. У більшості дітей кровоток в легенях збільшений, тому в клінічній картині переважає задишка і швидка стомлюваність в поєднанні з явищами серцевої недостатності, рецидивами інфекцій дихальних шляхів та затримкою фізичного розвитку. Ціаноз мінімальний або відсутній. Виражений ціаноз спостерігається при склеротичних змінах в легеневих судинах та при стенозі легеневої артерії. При цьому з’являється симптом “годинникових скелець” і “барабанних паличок”, розвивається поліцитемія. При кардіомегалії з’являється серцевий горб. Серцева недостатність виражена по право- та лівошлуночковому типу майже до картини набряку легень; вона менша при гіповолемії малого кола кровообігу і склеротичних змінах в легеневих судинах.
При аускультації по лівому краю грудини визначають грубий, довготривалий шум ДМШП, на верхівці може вислуховуватися мезодіастоличний шум відносного стенозу мітрального клапана – ознака гіперволемії малого кола кровообігу. При розвитку недостатності клапанів стовбура по лівому краю грудини з’являється протодіастолічний шум. Тони серця звучні, II тон над легеневою артерією акцентований, може бути єдиним і розщепленим. Часто визначається апікальний систолічний клік.
Супутні аномалії:
Супутня кардіальна патологія:
- ефект міжшлуночкової перетинки;
- атрезія мітрального клапана;
- єдиний шлуночок;
- аномалії дуги аорти (перерив, атрезія, праворозміщена дуга, судинне кільце, коарктація).
Супутня екстракардіальна патологія:
- характерні лицьові дизморфії: гіпертелоризм, короткі очні щілини, “набряклі” повіки, мікростомія, голос із носовим відтінком (щілини піднебіння, підслизові щілини);
- незначна затримка розумового розвитку чи затруднення у навчанні;
- аномалії розвитку скелетної мускулатури;
- патологія урогенітальної системи;
- аномалії кишечника.
Електрокардіограма специфічник ознак вади не має. У випадках підвищеного легеневого кровотоку ЕКГ-дані вказують на гіпертрофію обох шлуночків, збільшення лівого передсердя, при збідненні легеневого кровообігу знаходять ознаки гіпертрофії правого шлуночка, при легеневій гіпертензії в правих грудних відведеннях з’являються ознаки перевантаження по типу “strain”.
Фонокардіограма не має діагностичної цінності.
Більш специфічне рентгенологічне дослідження: легеневий судинний малюнок звичайно підсилений, але може бути і збідненим при стенозі легеневої артерії, при склеротичній фазі легеневої гіпертензії – збіднений переважно по периферії і підсилений в прикореневій зоні. Розміри серця залежать від легеневого кровообігу, частіше воно помірно збільшене (кардіоторакальний індекс – від 52 до 80%), форма серця кулеподібна, може стати яйцеподібною з вузьким судинним пучком, як при транспозиції магістральних судин, інколи серце схоже по формі на таке, як при тетраді Фалло, у вигляді “чобітка”. Правобічне розташування дуги аорти спостерігається у третини хворих, що в поєднанні з підсиленим легеневим кровообігом та ціанозом повинно викликати підозру на загальний артеріальний стовбур.
Ехокардіографія має важливе діагностичне значення. Вона дозволяє візуалізувати єдину широку судину, яка відходить від обох шлуночків, великий ДМШП, а також, в певних випадках, місце відходження легеневих артерій. Діагностичними ознаками також є відсутність другого півмісяцевого клапана і відсутність візуалізації легеневої артерії та її клапанного кільця в позиції по короткоосьовому перерізу з парастернального доступу.
М-сканування виявляє:
- відсутність безперервного септико-аортального продовження (при розташуванні верхом сидячої судини);
- вібрацію передньої стулки мітрального клапана в діастолу при клапанній недостатності артеріального стовбура.
Доплерівська ехокардіографія допомагає виявити стеноз клапана загального артеріального стовбура або його недостатність.
Катетеризація серця та ангіографія дозволяють підтвердити діагноз і визначити стан легеневих артерій, а також виявити супутні аномалії.
Диференційний діагноз:
Диференційна діагностика проводиться з синдромом Ді-Джорджі (188400), вело-кардіо-фаціальним синдромом (192430), геніто-палато-кардіальним синдромом (231060), тетрадою Фалло, атрезією легеневої артерії, транспозицією магістральних судин та синдромом Ейзенменгера.
Частота виникнення:
Якщо ВВС у новонароджених діагностують у 0,7-1,7%, то відсоток загального артеріального стовбура серед вроджених вад серця складає на клінічному матеріалі 1,7%, за даними секційного матеріалу – 3,9%.
Природний перебіг:
Смертність висока: до 60-70% на протязі півріччя і 80-90% на протязі першого року. Дуже рано настає недостатність кровообігу. Тільки 20% переживають перший рік життя, а 10% доживають до 1-3 десятиріччя. Виживання залежить від темпів прогресування змін в легеневих судинах і у віці 4 років 30% дітей неоперабельні. Відомі випадки, коли пацієнти доживали до 40-56 років. В основному це були пацієнти з склеротичними змінами в легеневих артеріях або з стенозом легеневих гілок.
Лікування:
Медикаментозне лікування: терапія застійної серцевої недостатності.
Хірургічне лікування: так як паліативні операції (звуження стовбура легеневої артерії або її гілок) малоефективні, в останні роки більшість хірургів надають перевагу ранньому (на першому році життя) проведенню радикальної операції, яка зводиться до закриття ДМШП, при цьому лівий шлуночок з’єднується заплатою з устям артеріального стовбура. Гілки легеневої артерії відсікаються і з’єднуються з правим шлуночком за допомогою кондуїта, що містить клапан (варіант операції Растелі). З віком виникає необхідність його заміни.
Профілактика:
- Медико-генетичне консультування.
- Пренатальна діагностика.
Як і при всіх вроджених вадах серця з високою неонатальною летальністю, перевагу необхідно надати перериванню вагітності. Рекомендується обстеження плода на предмет виявлення поєднаних серцевих та позасерцевих аномалій, включаючи визначення каріотипу. Необхідно проводити динамічний ультразвуковий нагляд з ціллю виявлення ознак застійної серцевої недостатності, які часто визначаються у плодів з недостатністю клапана артеріального стовбура.
Номер з каталогу МІМ:
217095 Conotruncal Heart Malformations; CTHM
Література:
- Банкл Г. Врожденные пороки сердца и крупных сосудов.- М.: Mедицина, 1980.
- Белоконь Н.А., Подзолков В.П. Врожденные пороки сердца.- М.: Медицина, 1990.- C. 224-231.
- Бураковский В.И., Бокерия Л.А. Сердечно сосудистая хирургия.- М.: Медицина,1989.
- Воробьев А.С., Бутаев Т.Д. Клиническая эхокардиография у детей и подростков.- СПб.
- Затикян Е.П. Кардиология плода и новорожденного.- М.: Инфо-Медиа, 1996.
- Becker TA, Van Amber R, Moller JH, Pierpont ME. Occurrence of cardiac malformations in relatives of children with transposition of the great arteries. Am J Med Genet. 1996 Dec 2;66(1):28-32.
- Butto F, Lucas RV Jr, Edwards JE. Persistent truncus arteriosus: pathologic anatomy in 54 cases. Pediatr Cardiol. 1986;7(2):95-101.
- Collet RW, Edwards JE. Persistent truncus arteriosus: A classification acording to anatomic types. Surg Clin North Am. 1949;29:1245.
- Debrus S, Berger G, de Meeus A, Sauer U, Guillaumont S, Voisin M, Bozio A, Demczuk S, Aurias A, Bouvagnet P. Familial non-syndromic conotruncal defects are not associated with a 22q11 microdeletion. Hum Genet. 1996 Feb;97(2):138-44.
- Devriendt K, Eyskens B, Swillen A, Dumoulin M, Gewillig M, Fryns JP. The incidence of a deletion in chromosome 22Q11 in sporadic and familial conotruncal heart disease. Eur J Pediatr. 1996 Aug;155(8):721.
- Emanuel BS, Budarf ML, Sellinger B, Goldmuntz E, Driscoll DA. Detection of microdeletions of 22q11.2 with fluorescence in situ hybridization (FISH): diagnosis of DiGeorge syndrome (DGS), velo-cardio-facial (VCF) syndrome, CHARGE association and conotruncal cardiac malformations. Am J Hum Genet. 51 (suppl.): A3, 1992.
- Marec B, Odent S, Almange C, Journel H, Roussey M, Defawe G. Le truncus arteriosus: une maladie autosomique recessive? J Genet Hum. 1989;37:225-230.
- Matsuoka R, Kimura M, Scambler PJ, Morrow BE, Imamura S, Minoshima S, Shimizu N, Yamagishi H, Joh-o K, Watanabe S, Oyama K, Saji T, Ando M, Takao A, Momma K. Molecular and clinical study of 183 patients with conotruncal anomaly face syndrome. Hum Genet. 1998 Jul;103(1):70-80.
- Matsuoka R, Takao A, Kimura M, Imamura S, Kondo C, Joh-o K, Ikeda K, Nishibatake M, Ando M, Momma K. Confirmation that the conotruncal anomaly face syndrome is associated with a deletion within 22q11.2. Am J Med Genet. 1994 Nov 15;53(3):285-9.
- Patterson DF, Pexieder T, Schnarr WR, Navratil T, Alaili R. A single major-gene defect underlying cardiac conotruncal malformations interferes with myocardial growth during embryonic development: studies in the CTD line of keeshond dogs. Am J Hum Genet. 1993 Feb;52(2):388-97.
- Pierpont ME, Gobel JW, Moller JH, Edwards JE. Cardiac malformations in relatives of children with truncus arteriosus or interruption of the aortic arch. Am J Cardiol. 1988 Feb 15;61(6):423-7.
- Rein AJ, Dollberg S, Gale R. Genetics of conotruncal malformations: review of the literature and report of a consanguineous kindred with various conotruncal malformations. Am J Med Genet. 1990 Jul;36(3):353-5.
- Rein AJ, Sheffer R. Genetics of conotruncal malformations: further evidence of autosomal recessive inheritance. Am J Med Genet. 1994 Apr 15;50(3):302-3.
- Saitta SC, McGrath JM, Mensch H, Shaikh TH, Zackai EH, Emanuel BS. A 22q11.2 deletion that excludes UFD1L and CDC45L in a patient with conotruncal and craniofacial defects. Am J Hum Genet. 1999 Aug;65(2):562-6.
- Takahashi K, Kido S, Hoshino K, Ogawa K, Ohashi H, Fukushima Y. Frequency of a 22q11 deletion in patients with conotruncal cardiac malformations: a prospective study. Eur J Pediatr. 1995 Nov;154(11):878-81.
- Thiene G, Bortolotti U, Gallucci V, Terribile V, Pellegrino PA. Anatomical study of truncus arteriousus communis with embryological and surgical considerations. Br Heart J. 1976 Nov;38(11):1109-23.
- Van Praagh R, Van Praagh S. The anatomy of common aorticopulmonary trunk (truncus arteriosus communis) and its embryologic implications. A study of 57 necropsy cases. Am J Cardiol. 1965;16(3):406-25.