Подвійне відходження магістральних судин від правого шлуночка
(Double Vessel Outlet)
Н.О. Лобінцева
Лікар УЗД
Хмельницької міської дитячої лікарні
Діагноз:
Подвійне відходження магістральних судин від правого шлуночка (ПВМС) – це комбінована вроджена вада серця (ВВС), при якій легеневий стовбур і аорта відходять від правого шлуночка. Вперше описано у 1866 році Paecock.
Діагностичні критерії:
Основні ознаки подвійного відходження магістральних судин з правого шлуночка:
- Головна ознака – переважне відходження обох судин – аорти і легеневої артерії від правого шлуночка серця.
- Два вихідні відділи в правому шлуночку – для аорти і легеневої артерії.
- Відсутність мітрально-аортального продовження.
- Наявність дефекту міжшлуночкової перегородки – єдиний шлях для опорожнення лівого шлуночка.
Вирізняють наступні варіанти ПВМС:
- Класичний варіант – відходження аорти і легеневої артерії від правого шлуночка з обов’язковим порушенням мітрально-аортального продовження.
- Синдром Тауссіг-Бінга – відходження аорти і легеневої артерії від правого шлуночка з підлегеневим розташуванням дефекту міжшлуночкової перегородки (ДМШП) з обов’язковим порушенням мітрально-аортального продовження.
- Відходження аорти і легеневої артерії від правого шлуночка з дефектом міжшлуночкової перегородки в стороні від устя аорти і легеневої артерії.
- Подвійне відходження магістральних судин з анатомією, характерною для тетради Фалло.
- Подвійне відходження магістральних судин від правого шлуночка з дефектом міжшлуночкової перегородки, який розташований над надшлуночковим гребнем.
Гемодинамічні порушення залежать від:
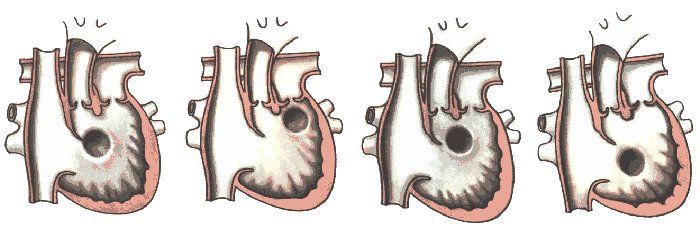
- розмірів і розташування ДМШП, який може бути:
- підаортальним (рисунок крайній зліва );
- підлегеневим (рисунок другий зліва);
- під обома магістральними судинами (рисунок третій зліва);
- віддалений від обох магістральних судин (рисунок крайній справа).
- наявності чи відсутності стенозу легеневої артерії;
- стану трьохстулкового клапану і прикріплення хордального апарату і сосочкових м’язів.
При підаортальному розташуванні ДМШП – венозна кров із правого шлуночка одним потоком поступає в легеневу артерію, а артеріальна кров через дефект міжшлуночкової перегородки в аорту. В цьому випадку у хворих артеріальна гіпоксемія відсутня або дуже незначна, тому що в велике коло кровообігу поступає в основному артеріальна кров. З народження визначається гіперволемія малого кола кровообігу. Ціанозу немає, але рано з’являється легенева гіпертензія. Якщо при такому розташуванні ДМШП є стеноз легеневої артерії, то гіпоксемія виражена з моменту народження.
При підлегеневому розташуванні ДМШП – в легеневу артерію поступає переважно артеріальна кров із лівого шлуночка, а в аорту – змішана венозна кров із правого шлуночка. Тому у цих хворих поряд із гіперволемією малого кола кровообігу виявляють значну артеріальну гіпоксемію і рано розвивається висока легенева гіпертензія.
Клінічні прояви вади:
Клінічно всі форми вади протікають важко, із швидким розвитком тяжких порушень гемодинаміки, легеневою гіпертензією і артеріальною гіпоксемією.
При спонтанному закритті ДМШП – наступає раптова смерть.
При підаортальному розташуванні ДМШП – клінічні прояви схожі із ізольованим ДМШП із високою легеневою гіпертензією. Швидко розвивається гіпотрофія ІІ-ІІІ ст., характерні рецидивуючі пневмонії, серцева недостатність, яка рефрактерна до лікування. Ціаноз з’являється при крику, що свідчить про вено-артерільне шунтування, у старших дітей є ознакою високої легеневої гіпертензії. Характерна задишка по типу тахіпное з участю допоміжної мускулатури. Аускультативно – вислуховується пов’язаний із І тоном грубий систолічний шум зліва на рівні 2-4 міжребер’я. Над легеневою артерією визначається акцентований, розщеплений ІІ тон; тут же при легеневій гіпертензії можуть вислуховуватися кліки, короткий протодіастолічний шум.
При наявності стенозу легеневої артерії клінічна картина абсолютно схожа з тетрадою Фалло. Характерні: задишка, грубий сістолічний шум запаморочення, ціаноз, а також задишечно-ціанотичні напади, які починаються раптово, дитина стає стурбована, посилюється задишка, ціаноз, зменшується інтенсивність шуму, потім можливе апное, втрата свідомості (гіпоксична кома).
При аномалії Тауссіг-Бінга (з підлегеневим розташуванням ДМШП) клінічна картина аналогічна повній транспозиції магістральних судин. З народження спостерігається генералізований ціаноз, задишка, відставання в фізичному розвитку. Вислуховується грубий систолічний шум з епіцентром в четвертому міжребер’ї біля правого краю грудини і виражений акцент ІІ тона над основою серця. Швидко розвивається гіпоксемія і серцева недостатність, після 1-3 місяців життя з’являється гіпотрофія, яка пов’язана з труднощами годування, відставання в моторному розвитку. Гіпоксемічні напади виникають не часто.
Поєднані симптоми:
У 60% випадків ПВМС із правого шлуночка поєднується із іншими ВВС:
- дефект міжшлуночкової перетинки (ДМШП) – вада, яка необхідна для життя;
- стеноз легеневої артерії – найчастіше поєднується із ПВМС із правого шлуночка і впливає на гемодинаміку та клінічні прояви;
- коарктація аорти;
- аномалія правої коронарної артерії;
- відкрита артеріальна протока;
- дефект міжпередсердної перетинки (ДМПП).
У 12,5% випадків ваду може супроводжувати екстракардіальна патологія:
- відсутність селезінки;
- аномалія положення органів;
- трахеостравохідна фістула;
- щілина твердого піднебіння і верхньої губи.
ПВМС із правого шлуночка може входити до складу:
- геніто-палато-кардіального синдрому Гартнера-Силенго-Ваштеля (ОМІМ 231060) – включає також гіпоспадію, розщеплення твердого та м’якого піднебіння, мікрогнатію;
- синдрому конотрункальних аномалій (ОМІМ 217095) – транспозиція магістральних судин, спільний артеріальний стовбур, мікроделеція 22q 11.2;
- синдрому летальних мальформацій Бімера (ОМІМ 209970) – гідроцефалія, гермафродитизм, тромбоцитопенія, специфічне обличчя з бульбоподібним носом і широким переніссям, витончені кістки;
- Трисомії 13 (синдром Патау) – мікроцефалія, щілина губи і піднебіння, полідактилія, мікрофтальмія, лицьові дизморфії, множинні вади розвитку внутрішніх органів.
Дані обстежень:
ЕКГ:
- при підаортальному розташуванні ДМШП без стенозу легеневої артерії – ознаки комбінованої гіпертрофії шлуночків серця з відхиленням електричної вісі серця;
- при підаортальному розташуванні ДМШП із стенозом легеневої артерії – відхилення електричної вісі вправо, порушення атріо-вентрикулярної та внутрішньошлуночкової провідності;
- при підлегеневому розташуванні ДМШП (аномалія Тауссіг-Бінга) – відхилення електричної вісі серця вправо, ознаки гіпертрофії правого передсердя і шлуночка.
ФКГ: дані не специфічні. Виявляють ознаки легеневої гіпертензії, стенозу легеневої артерії.
Рентгенологічна картина – неспецифічна. При стенозі легеневої артерії рентгенологічні ознаки нагадують картину при тетраді Фалло: незначне збільшення розмірів серця, внаслідок гіпертрофії стінок правого шлуночка і помірного розширення його порожнини, серце нагадує дерев’яний черевичок. Легеневий малюнок виражений нечітко. При аномалії Тауссіг-Бінга поряд з ознаками легеневої гіпертензії відмічається більш виражене вибухання легеневої артерії, ніж у хворих із подвійним відходженням магістральних судин по типу тетради Фалло, але без стенозу легеневої артерії.
Ультразвукова діагностика: цьому методу діагностики належить основна роль серед неінвазивних методів діагностики.
У позиції по довгій вісі лівого шлуночка із парастернального доступу візуалізуються:
- Дві магістральні судини, які відходять від правого шлуночка і мають паралельний хід. Півмісяцеві клапани аорти і легеневої артерії розташовані на одному рівні.
- Мітрально-півмісяцеве фіброзне продовження відсутнє. Візуалізується бульбарно-вентрикулярна складка, яка розділяє мітральний клапан і півмісяцевий клапан судини.
- Деформація вихідного відділу лівого шлуночка у вигляді Z-подібної конфігурації.
- Дефект міжшлуночкової перетинки.
У позиції по короткій вісі аорти із парастернального доступу встановлюють:
- розташування ДМШП;
- наявність стенозу легеневої артерії;
- взаємовідношення аорти і легеневої артерії;
- визначається розходження конусної перегородки, яка розділяє магістральні судини;
- відсутність сформованного надшлуночкового гребеня.
У чотирикамерній позиції із верхівкового та субкостального доступу визначають локалізацію ДМШП.
Доплерографія: допомагає в діагностиці супутніх клапанних змін – стеноз, недостатність, дефектів міжшлуночкової та міжпередсердної перегородок, дає можливість визначити градієнт тиску між лівим та правим шлуночком, аортою та правим шлуночком.
Остаточний діагноз вади може бути поставлений після проведення ангіографії.
Етіологія:
В більшості випадків причина виникнення цієї вади серця, як і інших ВВС, невідома. В 90% випадків вона має поліґенно-мультифакторіальне наслідування.
Патогенез:
Виникнення вади пов’язують з відсутністю процесу резорбції в примітивній сердечній трубці бульбарно-вентрикулярного гребня, що не дозволяє аорті після поділу загального артеріального стовбура переміститися в лівий шлуночок. Гребінь, який представлений міокардіальною тканиною, вклинюється між півмісяцевими та мітральним клапаном, утворюючи внутрішній край дефекту міжшлуночкової перетинки і обумовлюючи відсутність мітрально-півмісяцевого фіброзного продовження. Також при цьому відсутнє і легенево-трикуспідальне продовження. Ця вада виникає на 29-31 день запліднення.
Співвідношення між статтю: Ч 1 : Ж 1.
Частота виникнення:
Це вада серця, яка зустрічається відносно рідко – 1% від усіх ВВС. 1 : 125000.
Диференційний діагноз:
Необхідно проводити з дефектом міжшлуночкової перетинки, відкритим атріовентрикулярним каналом, тетрадою Фалло, повною транспозицією магістральних судин.
Лікування:
Може бути тільки оперативним. Для визначення можливості і характеру оперативного втручання необхідно чітко знати:
- Величину і взаємовідношення ДМШП з магістральними судинами.
- Взаємовідношення аорти і легеневого стовбура.
- Наявність чи відсутність стенозу легеневої артерії.
- Патологію атріо-вентрикулярних клапанів.
- Прикріплення хордального апарату і сосочкових м’язів.
- Ступінь легеневої гіпертензії.
При відсутності стенозу легеневого стовбура і легеневих артерій радикальна корекція вади показана в віці 12-24 міс.
У дітей раннього віку при поєднанні вади із стенозом легеневої артерії показано накладання міжартеріального анастомозу. Радикальна корекція вади при наявності стенозу легеневого стовбура показана у дітей старше 4 років.
При обструктивному ДМШП показане раннє оперативне втручання.
Вперше успішна радикальна коррекція класичного типу подвійного відходження магістральних судин від правого шлуночка була виконана в 1957 р. Kirklin.
Якщо ДМШП розташований в стороні від вустя магістральних судин, то хірургічна корекція вади становить значні труднощі.
Радикальна корекція виконується у хворих у віці старше 5-6 років. До цього віку виконують паліативну операцію – звуження легеневого стовбура або накладання міжартеріального анастомозу.
При аномалії Тауссіг-Бінга корекція вади значно складніша, тому що при цьому варіанті ПВМС від правого шлуночка важко створити пряме сполучення лівого шлуночка і аорти через віддаленність ДМШП від вустя аорти.
Основні причини смерті після хірургічної коррекції:
- гостра серцево-судинна недостатність, яка обумовлена високою легеневою гіпертензією;
- некориговані супутні вади;
- порушення ритму серця;
- високий систолічний градієнт тиску між лівим шлуночком і аортою;
- пошкодження коронарних артерій.
Найкращі віддалені післяопераційні результати спостерігаються при підаортальному розташуванні ДМШП.
Допологова діагностика:
Допологова діагностика затруднена, тому що вада не спричиняє антенатального порушення гемодинаміки. Специфічна пренатальна діагностика подвійного відходження магістральних судин із правого шлуночка викликає труднощі, оскільки ознаки тетради Фалло, транспозиції магістральних судин дуже схожі.
Прогноз:
Визначається варіантом подвійного відходження магістральних судин, наявністю супутніх патологій. Без хірургічного лікування прогноз захворювання несприятливий. Більшість хворих з легеневою гіпертензією гинуть на першому році життя. Тривалість життя більша, коли вада поєднується зі стенозом легеневої артерії і хворі доживали до 25-35 років. Смертність на першому році життя досягає 40%.
Профілактика:
Враховуючи важкість стану після народження, високу летальність після оперативних втручань, у 40% неоперабельність хворих, перевага віддається перериванню вагітності, особливо при поєднанні з іншими вадами розвитку.
Необхідно у всіх випадках виявлення вади проводити ретельне обстеження плоду для виключення поєднаних серцевих та позасерцевих аномалій, у тому числі визначення каріотипу. Рекомендується проводити динамічне ультразвукове обстеження з метою визначення ознак застійної серцевої недостатності. Поєднання водянки плоду із структурними дефектами серця відноситься до загрозливих ознак. Раціональна акушерська тактика не розроблена до кінця. Оптимальним може бути дострокове родорозрішення, але батьки повинні знати, що смертність дітей при цій ваді дуже висока. При відсутності ознак застійної серцевої недостатності стандартна акушерська тактика не має альтернативи, але родорозрішення потрібно проводити в спеціалізованих центрах, де можливе надання необхідної кардіохірургічної допомоги.
Номер з каталогу МІМ:
217095 Conotrunkal Heart Malformation; CHTM
231060 Genitopalatocardiac Syndrome
209970 Beemer Lethal Malformation Syndrome
Література:
- Белозеров Ю.М., Болбиков В.В. Ультразвуковая диагностика и симеотика в кардиологии детского возраста.- М.: Медпресс, 2001.
- Белоконь Н.А., Подзолков В.П. Врожденные пороки сердца.- М.: Медицина, 1991.
- Детская ультразвуковая диагностика /Под общей редакцией М.И. Пыкова, К.В. Ватолина.- М.: Издательский дом Видар-М, 2001.
- Затикян Е.П. Кардиология плода и новорожденного.- М.: Инфо-медиа, 1996.
- Ромеро Роберто. Пренатальная диагностика врожденных пороков развития плода.- М.: Медицина, 1994.
- Сердечно-сосудистая хирургия /Под ред. В.И. Бураковского, Л.А. Бокерия.-М.: Медицина, 1989.
- Brewer S, Jiang X, Donaldson S, Williams T, Sucov HM. Requirement for AP-2alpha in cardiac outflow tract morphogenesis. Mech Dev 2002 Jan;110(1-2):139-49.
- Brown JW, Ruzmetov M, Okada Y, Vijay P, Turrentine MW. Surgical results in patients with double outlet right ventricle: a 20-year experience. Ann Thorac Surg 2001 Nov;72(5):1630-5.
- Fraisse A, Ghez O, Ligi I, Laporte-Giugliano V, Chetaille P, Bonnet JL, Aubert F, Metras D. Dextrocardia with situ solitus, ventricular loop, double outlet hypoplastic right ventricle and L-malposition of the great arteries. Description and surgical treatment of a rare and complex cardiopathy. Arch Mal Coeur Vaiss 2002 May;95(5):495-9.
- Freedom RM, Yoo SJ. Double-outlet right ventricle: Pathology and angiocardiography. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2000;3:3-19.
- Goldmuntz E, Bamford R, Karkera JD, dela Cruz J, Roessler E, Muenke M. CFC1 mutations in patients with transposition of the great arteries and double-outlet right ventricle. Am J Hum Genet 2002 Mar;70(3):776-80.
- Ito M, Takagi N, Sugimoto S, Oosawa H, Abe T. Pregnancy after undergoing the Fontan procedure for a double outlet right ventricle: report of a case. Surg Today 2002;32(1):63-5.
- Lascano ME, Schaad MS, Moodie DS, Murphy D Jr. Difficulty in diagnosing double-chambered right ventricle in adults. Am J Cardiol 2001 Oct 1;88(7):816-9.
- Manner J. On the value of morphogenetic classifications of hearts with double outlet right ventricle. Cardiol Young 2001 Nov;11(6):689-90.
- Oshima Y, Yamaguchi M, Yoshimura N, Oka S, Ootaki Y. Anatomically corrective repair of complete atrioventricular septal defects and major cardiac anomalies. Ann Thorac Surg 2001 Aug;72(2):424-9.
- Puga FJ. The role of the Fontan procedure in the surgical treatment of congenital heart malformations with double-outlet right ventricle. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2000;3:57-62.
- Smallhorn JF. Double-outlet right ventricle: An echocardiographic approach. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2000;3:20-33.