Serhiy
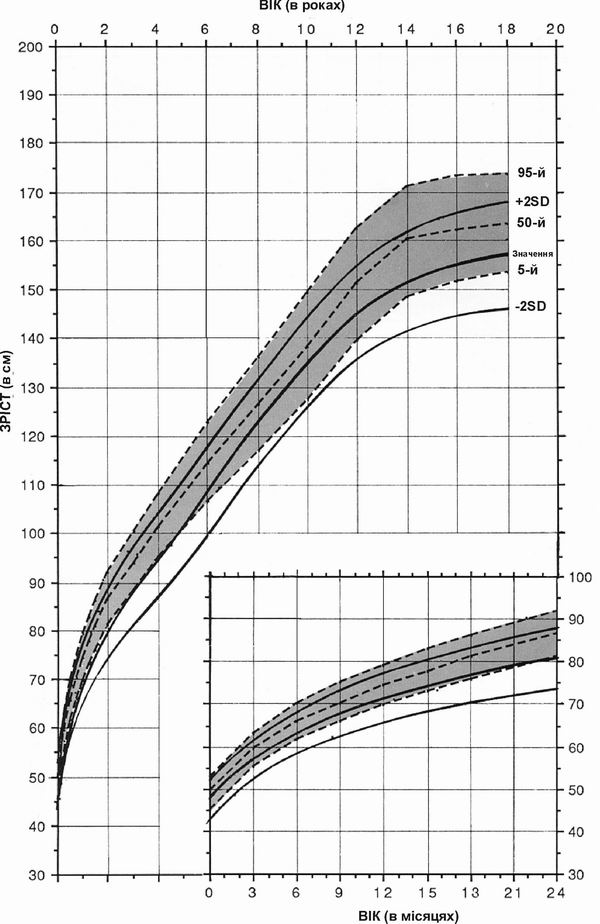
Синдром Вільямса – зріст дівчат
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”.
Дані про зріст дівчаток з синдромом Вільямса, зібрані в результаті обстеження 61 пацієнтки. Пунктирними лініями на діаграмі показані нормальні темпи збільшення зросту; суцільною лінією – динаміка розвитку осіб з синдромом Вільямса. Діаграми створено Collen A.Morris, M.D., Susan A.Demsey, M.S., Clair O.Leonard, M.D., Constance Dilts, M.A., and Brent Blackburn, B.A. The Williams Syndrome National Association is gratefully acknowledged for their cooperation.
Синдром Вільямса – вага дівчат
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”.
Дані про вагу дівчаток з синдромом Вільямса, зібрані в результаті обстеження 61 пацієнтки. Пунктирними лініями на діаграмі показані нормальні темпи збільшення ваги; суцільною лінією – динаміка розвитку осіб з синдромом Вільямса. Діаграми створено Collen A.Morris, M.D., Susan A.Demsey, M.S., Clair O.Leonard, M.D., Constance Dilts, M.A., and Brent Blackburn, B.A. The Williams Syndrome National Association is gratefully acknowledged for their cooperation.
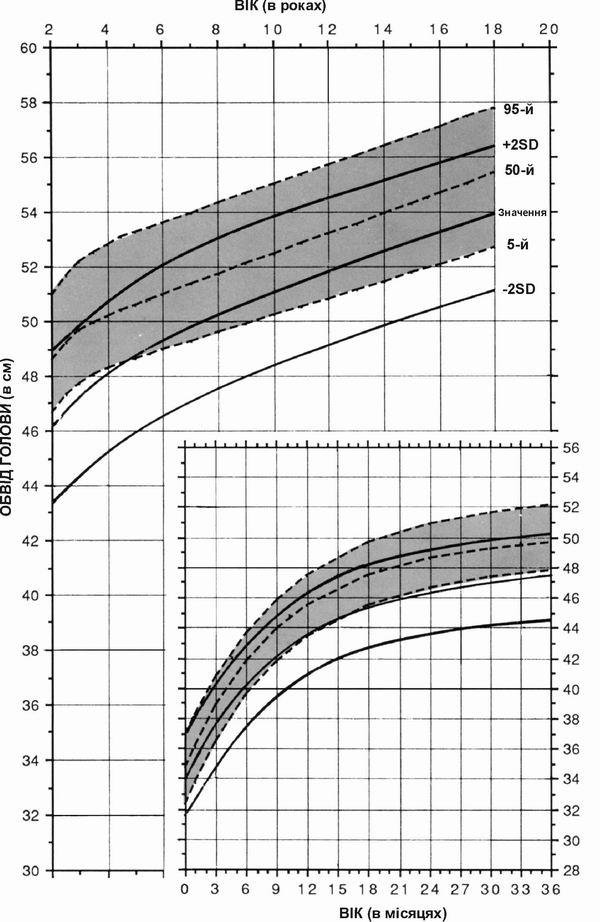
Синдром Вільямса – обвід голови у хлопчиків
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”.
Дані про обвід голови хлопчиків з синдромом Вільямса, зібрані в результаті обстеження 47 пацієнтів. Пунктирними лініями на діаграмі показані нормальні темпи збільшення обводу голови; суцільною лінією – динаміка розвитку осіб з синдромом Вільямса. Діаграми створено Collen A.Morris, M.D., Susan A.Demsey, M.S., Clair O.Leonard, M.D., Constance Dilts, M.A., and Brent Blackburn, B.A. The Williams Syndrome National Association is gratefully acknowledged for their cooperation.
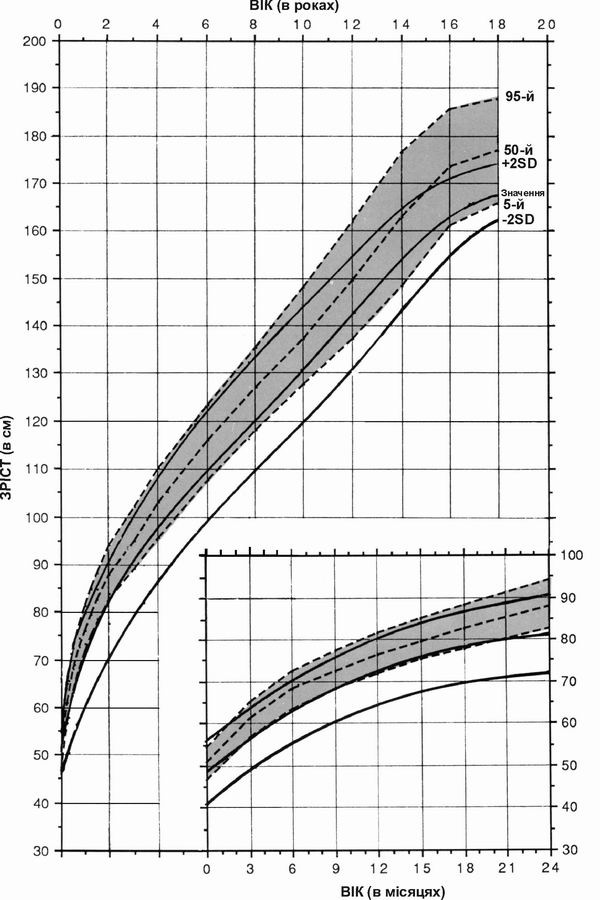
Синдром Вільямса – зріст хлопчиків
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”.
Дані про зріст хлопчиків з синдромом Вільямса, зібрані в результаті обстеження 47 пацієнтів. Пунктирними лініями на діаграмі показані нормальні темпи збільшення зросту; суцільною лінією – динаміка розвитку осіб з синдромом Вільямса. Діаграми створено Collen A.Morris, M.D., Susan A.Demsey, M.S., Clair O.Leonard, M.D., Constance Dilts, M.A., and Brent Blackburn, B.A. The Williams Syndrome National Association is gratefully acknowledged for their cooperation.
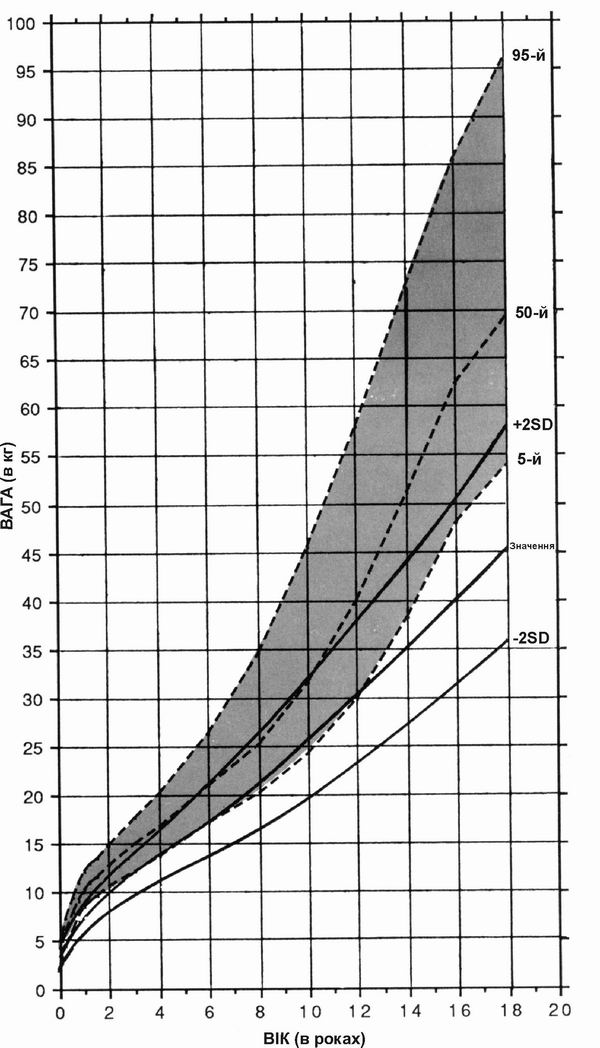
Синдром Вільямса – вага хлопчиків
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”.
Дані про вагу хлопчиків з синдромом Вільямса, зібрані в результаті обстеження 47 пацієнтів. Пунктирними лініями на діаграмі показані нормальні темпи збільшення ваги; суцільною лінією – динаміка розвитку осіб з синдромом Вільямса. Діаграми створено Collen A.Morris, M.D., Susan A.Demsey, M.S., Clair O.Leonard, M.D., Constance Dilts, M.A., and Brent Blackburn, B.A. The Williams Syndrome National Association is gratefully acknowledged for their cooperation.
Синдром Вільямса
(Williams Syndrome)
Наталія Шкапій
Інформаційний спеціаліст Хмельницького ОМНІ-центру
Що таке синдром Вільямса?
Синдром Вільямса (СВ) – це рідкісне генетичне захворювання, що зустрічається з частотою 1:20000 і є причиною ряду медичних проблем.
Синдром Вільямса, вперше описаний у 1961 році, трапляється серед представників усіх етнічних груп та національностей, з однаковою частотою уражаючи дівчаток і хлопчиків.
Які ознаки синдрому Вільямса?
Характерні риси обличчя. Більшість дітей з СВ мають характерні риси обличчя, так зване “обличчя ельфа”, що надають їм певної подібності між собою: маленький кирпатий ніс, довгий фільтр (відстань між верхньою губою та нижнім краєм перегородки носа), широкий рот, повні губи, маленьке підборіддя, “подушечки” навколо очей. У дітей з блакитними та зеленими очима чітко помітний мереживний малюнок на райдужній оболонці ока. З віком риси обличчя проявляються ще більше. Лише досвідчений фахівець-генетик може за цими ознаками розпізнати синдром Вільямса.
Проблеми з серцево-судинною системою. Більшість дітей з СВ мають певні захворювання серцево-судинної системи. Як правило, це звуження аорти або легеневої артерії різного ступеня вираженості – від незначного до такого, що потребує тільки оперативного лікування. Через підвищений ризик розвитку звуження кров’яних судин та артеріальної гіпертензії необхідними є огляди кардіолога.
Гіперкальціємія (підвищений рівень кальцію в крові). Деякі діти з СВ мають підвищений рівень кальцію в крові. Причина цього невідома. При гіперкальціємії можливе загострення колік. Часом необхідними є дієта та медикаментозне лікування. У більшості випадків рівень кальцію нормалізується сам по собі, однак надлишок кальцію та вітаміну D може спостерігатись протягом всього життя.
Мала вага при народженні. Багато дітей з СВ мають дещо меншу вагу при народженні, ніж їхні брати та сестри. Протягом перших років життя діти погано набирають вагу. В дорослому ж віці зріст осіб з СВ нижчий від середнього.
Вигодовування. Багато немовлят та дітей молодшого віку мають проблеми з вигодовуванням. В основному, причиною цього є низький тонус м’язів, сильний блювотний рефлекс, слабке смоктання та ковтання та ін. З віком ці проблеми самостійно проходять.
Збудливість (коліки в період новонародженості). Багато дітей з СВ мають довгий період коліки або збудливості. Як правило, він триває від 4 до 10 місяців життя, а потім зникає. Імовірною причиною є гіперкальціємія. Характерними також є порушення режиму сну, що є результатом колік.
Аномалії зубів. Для дітей з СВ характерні дещо зменшені, широко розміщені зуби. Звичними є також неправильний прикус, форма та вигляд зубів. Усі ці зміни піддаються лікуванню ортодонта.
Аномалії нирок. Суттєво підвищена частота захворювань нирок та порушення їх функцій.
Кили. Черевні та пупкові кили у дітей з СВ зустрічаються частіше, ніж у загальній популяції.
Підвищена чутливість до звуків. Діти із СВ значно чутливіші до звуків, ніж інші. Деякі частоти або шуми можуть бути болючими або дратувати осіб з СВ. З віком така особливість зникає.
М’язево-скелетні проблеми. Маленькі діти з СВ часто мають низький тонус м’язів та слабкість суглобів. З віком можуть розвинутись контрактури (обмежена рухливість) суглобів. Фізичні вправи допомагають посилити тонус м’язів та збільшити рухливість суглобів.
Підвищена соціальна активність. Діти з СВ дуже дружелюбні. Вони надзвичайно комунікабельні, ввічливі у спілкуванні. Як правило, вони не відчувають страху перед незнайомцями і з більшим задоволенням спілкуються з дорослими, ніж зі своїми однолітками.
Затримка розвитку, проблеми з навчанням та знижена увага. Більшість людей з СВ мають певну затримку розумового розвитку. Маленькі діти з СВ часто відстають у розвитку, пізно починають ходити, розмовляти та самостійно ходити у туалет. Старші діти та дорослі з СВ часто демонструють інтелектуальну “силу та слабкість”. В деяких розумових сферах (мовлення, довгострокова пам’ять, соціальні здібності) дитина розвивається досить успішно, однак в інших – таких як просторове уявлення та тонка моторика, спостерігається значна затримка.
Що є причиною СВ?
Відомо, що у більшості осіб з СВ має місце мутація (делеція) в 7 хромосомі, включаючи ген, що кодує синтез білка еластину (протеїну, що відповідає за міцність та еластичність стінок судин). Схоже, що саме мікроделеція гена еластину є причиною багатьох характерних ознак СВ. Можливі різноманітні мутації цього гена, які зумовлюють відмінності (нюанси) у проявах захворювання.
У більшості сімей, дитина з СВ є єдиною в цій родині. Однак особа з СВ має 50% можливості передати хворобу своїй дитині.
Як діагностується СВ?
На жаль, часто діагностика є запізнілою, у пізньому віці, або взагалі відсутньою. Але це не стосується тих випадків, коли розвиваються складні порушення стану здоров’я. Якщо ж виявляються ознаки СВ, необхідним є генетичне консультування.
Клінічний діагноз можна підтвердити аналізом крові, так званою методикою FISH. Цей діагностичний тест ДНК визначає мікроделецію 7 хромосоми у більше ніж, 98% осіб з СВ.
Який прогноз щодо життя?
Життя пацієнта з СВ залежить від своєчасного встановлення діагнозу. Але в багатьох випадках СВ вчасно не розпізнають і роблять висновки зі значною затримкою. Невиявлена хвороба або несвоєчасний діагноз небезпечні для хворого, оскільки, наприклад, анестезія при оперативному втручанні може спричинити раптову смерть.
Моїй дитині ще не проводили генетичну діагностику. Де можна зробити таке тестування?
Ви можете звернутись до найближчої генетичної лабораторії, яка проводить FISH-аналіз, щоб підтвердити або спростувати діагноз СВ. Якщо ж поблизу немає такої лабораторії, лікар може замовити проведення FISH – аналізу в іншій цитогенетичній лабораторії. Але лікар повинен точно вказати мету дослідження – встановлення мікроделеції 7 хромосоми. Звичайне цитогенетичне дослідження не виявляє ознак СВ.
Хто повинен піклуватись про осіб з СВ?
Широкий спектр медичних проблем у пацієнтів з СВ зумовлює необхідність нагляду лікарів різних фахів протягом усього життя. Постійні огляди на предмет потенційних проблем зі здоров’ям повинні проводитись спеціалістом, який знайомий з різноманітними проявами СВ.
Зважаючи на розумову “силу та слабкість”, рекомендуються постійні нагляди психіатрів, спеціалістів з розвитку мови та мовлення, терапевтів і т.д., які знайомі з проблемами, що можуть виникнути в осіб з СВ.
Хто може допомогти батькам дітей із СВ?
Часто батьки дітей з вродженими вадами організовуються в групи, де обговорюють питання, що їх цікавлять. Вони обмінюються досвідом, розповідають про досягнення та успіхи своїх дітей. Можливо, створення батьківської групи СВ допоможе вам у вирішенні багатьох проблем, пов’язаних з розвитком та вихованням вашої дитини.
Я багато читала про те, що діти з СВ дуже музичні. Як я можу дізнатись, чи є такі здібності в моєї дитини і як я можу розвинути їх?
Люди з СВ живуть із музикою в серці. Здається, ніби музика на кінчиках їхніх пальців. Незважаючи на проблеми в інших сферах життя, вони повністю віддаються музиці і дуже чутливі до всього, що стосується музики.
Якщо дитина ще маленька, зверніть увагу на те, щоб познайомити її з усіма видами музики, розвинути музичні здібності у дитячому садочку, де є класи музики. Коли дитина підросте і зможе деякий час працювати з учителем, віддайте дитину в музичну школу. Найкраще починати з музичного синтезатора. Деякі музичні школи пропонують 10-15 хвилинні уроки з різноманітними музичними інструментами, щоб дитина змогла визначитись, який з музичних інструментів подобається їй найбільше.
Чи є проблеми зі здоров’ям частими для осіб з СВ?
При СВ можуть уражатися різноманітні органи людського тіла. Але потрібно також пам’ятати, що люди з СВ мають далеко не однакові проблеми зі здоров’ям. Оскільки деякі захворювання можуть виникнути з часом, необхідний постійний нагляд лікарів. Незважаючи на можливість мати ускладнення хвороби, багато дітей та дорослих із СВ почуваються добре і ведуть активний спосіб життя.
Я багато читала, про характерні особливості СВ. І в моєї дитини будуть усі вони?
Ні, не обов’язково. Наприклад, у деяких людей з СВ не буде проблем з серцево-судинною системою, а інші не матимуть гострого слуху або будуть низькі на зріст. Так само, хоча більшість дітей з СВ балакучі та дружелюбні, інші ж – небагатослівні та замкнені у собі.
Коли потрібно проводити медичні огляди дитини?
Ваша дитина повинна оглядатись лікарями тоді, коли це тільки можливо. Це допоможе встановити коло спеціалістів, що працюватимуть з вашою дитиною в подальшому. Більшість дітей з СВ займаються зі спеціалістом з розвитку мови та мовлення.
Чи маю я ризик народження ще однієї дитини із СВ?
СВ виникає спонтанно. Дослідники вважають, що частота СВ становить 1 на 20000 вагітностей, і не змінюється з наступними вагітностями. Тому це майже неймовірно, що ви народите ще одну дитину з СВ.
Які освітні програми будуть найкращими для моєї дитини дошкільного віку?
Діти з СВ мають розвинені пізнавальні здібності, тому їм не надто необхідні спеціальні навчальні програми. Одним з найкращих підходів до “програмування” навчання дитини є тісна співпраця батьків та медичних спеціалістів. Необхідно створити команду для підтримки вашої дитини. І ви, як батьки дитини, повинні бути невід’ємним членом цієї команди, створюючи програму, яка б дозволяла розвиватись вашій дитині розумово та фізично. Ви можете радитись з лікарями, щоб дізнатись, що є найкращим саме для вашої дитини.
Чи зможе моя дитина навчатись у вищих навчальних закладах, працювати та жити самостійно?
Ми вже згадували раніше, що існує широкий спектр здібностей дітей з СВ. Для деяких навчання в коледжі буде важким, хоча інші навчаються досить успішно.
Багато дорослих пацієнтів з синдромом Вільямса можуть жити окремо, інші ж залишаються під опікою батьків.
Переглянуто редакційною колегією I.B.I.S.: 27/01/2003
Дивіться також:
- Синдром Вільямса (інформація для спеціалістів)
- Синдром Вільямса (методичні рекомендації)
- Синдром Вільямса (діаграми розвитку дітей)
Синдром Вільямса
(Williams Syndrome)
Наталія Григорівна Горовенко
Д-р мед. наук, професор, чл.-кор. АМН України,
Київська медична академія після дипломної освіти ім. П.Л. Шупика
Тетяна Едуардівна Зерова-Любимова
Канд. біолог. наук,
Київська медична академія після дипломної освіти ім. П.Л. Шупика
Наталія Олексіївна Тищенко
Київська медична академія після дипломної освіти ім. П.Л. Шупика
Олена Генадіївна Євсеєнкова
Київська медична академія після дипломної освіти ім. П.Л. Шупика
Рецензент:
Ігор Романович Бариляк
Д-р мед. наук, професор,
Голова проблемної комісії “Медична генетика” МОЗ і АМН України
Перелік умовних скорочень:
FISH – флуоресцентна іn situ гібридизація
МРТ – магнітно-резонансна томографія
Ехо-КГ – ехо-кардіографія
УЗД – ультразвукове дослідження
УФ випромінювання – ультрафіолетове випромінювання
Вступ:
Синдром Вільямса – мультисистемне захворювання, причиною якого є мікроделеція сегменту 7q11.23. Частота синдрому складає 1:20000 новонароджених. Основними клінічними ознаками є дизморфічні риси обличчя, затримка розумового розвитку та труднощі навчання, унікальні психологічні особливості, гіперкальціємія, сполучнотканинні аномалії, що обумовлені дефектом гену еластину ELN. За допомогою флуоресцентної іn situ гібридизації (FISH) ідентифікувати мікрохромосомну аномалію (мікроделецію 7q11.23) можна у 99% пацієнтів з клінічними ознаками синдрому Вільямса. Лабораторне підтвердження діагнозу дає можливість правильно визначити прогноз і тактику ведення хворого, провести медико-генетичне консультування в родині.
В Україні тільки нещодавно з’явилася можливість проведення підтверджуючої лабораторної діагностики синдромів з мікроабераціями хромосом, і зокрема синдрому Вільямса за допомогою флуоресцентної гібридизації in situ (FІSH). Незважаючи на те, що синдром Вільямса має дуже специфічну клінічну картину, знайомі з ним практично лише фахівці з вузькою спеціалізацією – генетики. Трапляються випадки пізньої діагностики синдрому в дорослому віці, коли проведення реабілітаційних медичних та педагогічних заходів вже не дають ефекту. Своєчасна діагностика синдрому та дотримання рекомендованої тактики ведення хворих з синдромом Вільямса дозволяє в багатьох випадках значно поліпшити медичний та, особливо, соціальний прогноз для пацієнтів. Крім того, застосування молекулярно-цитогенетичного тесту дає можливість провести високодостовірну пренатальну діагностику та медико-генетичне консультування в родині.
Методичні рекомендації по клінічній та лабораторній діагностиці синдрому Вільямса, особливостям реабілітації хворих та медико-генетичному консультуванню підготовлені вперше в Україні і базуються на великому практичному досвіді авторів та рекомендаціях провідних генетичних та педіатричних установ світу.
Матеріал, викладений в методичних рекомендаціях, призначений для лікарів-генетиків, неонатологів, педіатрів, кардіологів, кардіохірургів, дитячих неврологів та психіатрів.
Основна частина:
Перший опис синдрому було зроблено Williams JC із співавторами в 1961 році. Роком пізніше, у 1962 році, Beuren AJ із співавторами доповнили спектр фенотипових ознак синдрому, який включав надклапанний стеноз аорти, специфічні риси обличчя та розумову відсталість. Пізніше було виявлено, що більшість пацієнтів мають також ідіопатичну гіперкальціємію. Слід зазначити, що випадки ідіопатичної гіперкальціємії були описані і раніше в Англії після другої світової війни під час епідемії гіперкальціємії новонароджених, яка була наслідком перенасичення дитячого харчування вітаміном Д. Після зниження вмісту вітаміну Д рівень кальцію у більшості дітей нормалізувався, але у деяких пацієнтів гіперкальціємія залишилась, крім цього у них спостерігались незвичайні риси обличчя та затримка розвитку. Цей особливий стан отримав назву синдрома Вільямса – Бойрена, або „обличчя ельфа” (враховуючи специфічність рис обличчя пацієнтів в дитинстві). З введенням в практику флуоресцентної in situ гібридізації було виявлено, що 99% хворих мають мікроделецію сегменту q11.2 хромосоми 7.
Етіологія:
Причиною розвитку синдрому Вільямса є мікроделеція сегменту q11.2 хромосоми 7 розміром ~1,5 Mb, в якому картовано 16 генів, включаючи ген еластину ELN. Саме втрата гену еластину і обумовлює розвиток всієї сукупності сполучнотканинних аномалій, які спостерігаються при цьому синдромі. З’ясовано, що делеція з однаковою частотою має як материнське, так і батьківське походження. Мейотичні помилки саме в цьому сегменті, в так званій гарячій точці, обумовлені наявністю в цій ділянці хромосоми 7 великої кількості повторів тринуклеотидних послідовностей. Чіткого взаємозв’язку між більшістю картованих в критичній ділянці генів та фенотиповими проявами синдрому Вільямса не виявлено, хоча відомо, що гени FZD3, BCL7B, STX1A, LIMK1, та CYLN2 експресуються в нервовій тканині, і тому можуть мати вплив на особливості нервово-психічного розвитку при синдромі Вільямса.
Таблиця 1. Гени, які картовано в ділянці, що делетована при синдромі Вільямса
(Annu. Rev. Genomics Hum. Genet. 2000. 1:461–484)
Клініка:
До головних ознак синдрому Вільямса відносяться: специфічні риси обличчя, сукупність яких дає враження „обличчя ельфа”, вроджені вади серця (найбільш специфічною є надклапанний стеноз аорти), як один з проявів аномалій сполучної тканини, ідіопатична гіперкальціємія та гіперкальціурія на першому році життя, затримка розумового розвитку з формуванням особливого психо-когнітивного профілю. Крім основних симптомів, хворі мають затримку фізичного розвитку та порушення інших органів та систем.
Лицьовий дизморфізм в періоді новонародженості та ранньому дитинстві включає: широкий лоб, бітемпоральне звуження, низьке перенісся, періорбітальна припухлість, зірчаста райдужка, косоокість, короткий ніс або відкриті наперед ніздрі, довгий фільтр, повні губи, широкий рот, повні щоки, порушення прикусу та дрібні зуби, мікрогнатія, виступаюча часточка вушної мушлі. Слід зазначити, що повний спектр перелічених малих аномалій обличчя, який дає враження “обличчя ельфа” та дозволяє поставити клінічний діагноз, формується на 3-4-му році життя. Проте вже після 10-15-річного віку для пацієнтів з синдромом Вільямса характерним є довге обличчя, довга шия, виступаючі надбрівні дуги, пласка середня третина обличчя, широкий рот та повні губи, вузьке перенісся, широкий кінчик носа.
До спектру сполучнотканинних аномалій входять грубий голос, за рахунок змін голосових зв’язок, пахові та пупкові кили, дивертикули кишок або сечового міхура, гіпереластичність шкіри, гіпермобільність суглобів, а також серцево-судинні порушення.
Аномалії серцево-судинної системи присутні більш ніж у 80% хворих. Найбільш частою маніфестацією еластинової артеріопатії є надклапанний стеноз аорти. Також виявляють периферичний стеноз легеневої артерії, пролапс мітрального клапану, артеріальну гіпертензію. З віком ступінь артеріального стенозу збільшується. Розвиток обструкції можливий в будь-якій ділянці артеріального русла. Стенози коронарних судин бувають частою причиною раптової смерті у деяких хворих з синдромом Вільямса. Звуження судин головного мозку можуть спричинити розвиток інсульту. Стенози ниркових артерій – це найбільш часта причина артеріальної гіпертензії, вона присутня у близько 50% пацієнтів. Взагалі, саме серцево-судинні аномалії є основною причиною смерті при синдромі Вільямса.
Ідіопатична гіперкальціємія спостерігається зазвичай протягом перших 18 місяців життя. Високий рівень кальцію крові мають до 15% дітей, високий рівень екскреції кальцію з сечею (гіперкальціурію) мають до 30% дітей на першому році життя. Гіперкальціємія може спричиняти розвиток дратівливості, блювання, закрепу та крампі (болючих посмикувань м’язів). Гіперкальціурія може бути причиною розвитку нефрокальцинозу в дорослому віці. Етіологія порушення метаболізму кальцію при синдромі Вільямса ще не з’ясована.
Особливості психомоторного розвитку. Однією з найчастіших фенотипових ознак синдрому Вільямса є особливості психомоторного розвитку та деякі риси особистості пацієнтів, а саме, надзвичайна дружелюбність пацієнтів при наявності у них середньої та легкої ступені розумової відсталості, яка діагностується у 75% дітей.
Вже з перших років життя відмічається нерівномірна структура порушеного психомоторного розвитку.
- Перше півріччя – спостерігається затримка розвитку інтегративних функцій, які безпосередньо пов’язані з руховим аналізатором, та насамперед зорово-моторною координацією. В подальшому все більше проявляється порушення моторних функцій та координації рухів. Це призводить до специфічних труднощів в оволодінні навичками самообслуговування. Наявність моторної недостатності та відставання в строках розвитку статичних та локомоторних функцій інколи призводить до помилкового встановлення діагнозу дитячого церебрального паралічу.
- Ранній дитячий вік – відзначається значне відставання в темпах мовного розвитку. Згідно деяких спостережень перші слова діти з синдромом Вільямса починають говорити не раніше 2,5-3 років. З віком затримка мовного розвитку змінюється високою мовною активністю, надмірною балакучістю. Діти легко повторюють мову дорослих, багато говорять, але часто недоречно. Спостерігаються порушення вимовляння звуків, причиною є дефекти зубо-щелепної системи та дизартрія. В деяких випадках висока мовна активність, легкість повторювання окремих слів та фраз може вдало маскувати інтелектуальну недостатність.
- Шкільний вік – нерівномірність психічного розвитку проявляє себе у вигляді різної здібності до засвоєння математики та читання. Зазвичай відмічаються труднощі в оволодінні рахуванням, навіть виконання простих математичних дій на конкретних прикладах. Читання дається відносно легко. Порушення у сфері розвитку тонкої моторики обумовлює труднощі в оволодінні письмом. До психологічних проблем хворих з синдромом Вільямса також відносяться порушення уваги з гіперактивністю та тривожність. Розумова відсталість може сполучатися з незрілістю емоційно-вольової сфери. Частина хворих має ознаки лобної недостатності: діти не враховують поточної ситуації, у них відсутня самокритичність, часто спостерігається ейфорія з порушеннями регуляторної діяльності. Діти з синдромом Вільямса, як часто відзначають батьки, мають хороший музичний слух, відчуття ритму і схильні до занять музикою та співом.
- Поведінка дітей з синдромом Вільямса в цілому характеризується надзвичайною дружелюбністю, високою соціальною активністю, чутливістю, легкістю в зав’язуванні нових контактів, лагідністю. Хворі не за віком наївні та дуже безпосередні. Діти легко виконують вказівки дорослих, але їхня особиста діяльність часто неорганізована. Емоційні особливості дітей з синдромом Вільямса обумовлюють прихильність до них оточуючих, особливо дорослих.
Фізичний розвиток при синдромі Вільямса характеризується низьким зростом та малою вагою тіла. Пренатальна затримка росту спостерігається у 50-70% випадків. Причинами затримки росту та повільної прибавки ваги у новонароджених часто є порушення годування, гастроезофагальний рефлюкс, хронічний закреп. До 70% дітей мають зріст нижче середнього показника зросту їхніх батьків. Пубертат настає зазвичай раніше ніж у однолітків, але передпубертатний ростовий стрибок дуже короткий, тому зріст більшості дорослих пацієнтів з синдромом Вільямса нижче 3 центиля.
Неврологічні порушення у дітей з синдромом Вільямса включають гіпотонію, гіперрефлексію, ознаки порушення функції мозочка. В деяких випадках, при проведенні МРТ головного мозку, виявлялось зменшення об’єму мозку зі збереженням нормальних розмірів мозочка, також описані поодинокі випадки наявності мальформації Кіарі І (зміщення мозочка у каудальному напрямку).
Офтальмологічні аномалії включають конвергентну косоокість, гіперметропію, гіпоплазію строми радуйжки, зниження гостроти зору.
Орган слуху. Ще однією особливістю при синдромі Вільямса є гіперчутливість до гучних звуків, яка має місце у пацієнтів будь-якого віку. У дітей молодшого віку часто розвивається хронічний отит.
Порушення функції травної системи включають порушення годування у вигляді зригувань, рефлюксну хворобу, закріп (до 40%) та дивертикульоз кишок. Причинами хронічного абдомінального болю у дорослих із синдромом Вільямса можуть бути виразкова хвороба, жовчокам’яна хвороба, дивертикульоз, хронічний закреп або кила стравохідного отвору діафрагми.
Аномалії сечовивідної системи при синдромі Вільямса включають вади розвитку нирок, дивертикули сечового міхура, нефрокальциноз. До 50% дітей з синдромом Вільямса страждають на енурез, до 30% дорослих хворих мають хронічні інфекційні захворювання сечових шляхів.
До вад розвитку м’язової-скелетної системи, що описані у хворих з синдромом Вільямса, відносять радіоульнарний синостоз, кіфоз, лордоз та сколіоз. У дітей часто спостерігається гіпермобільність суглобів, але в більш дорослому віці формуються контрактури. Аномалії суглобів в комбінації з постуральними порушенням призводять до формування порушень ходи.
Діагностика синдрому Вільямса:
Діагноз синдрому Вільямса встановлюється при наявності достатньої кількості характерних клінічних ознак (табл. 3) (клінічний діагноз) та підтверджується молекулярно-цитогенетичним методом дослідження за допомогою FISH (заключний діагноз). Останній виконується в спеціалізованому медико-генетичному центрі на кафедрі медичної генетики КМАПО ім. П.Л. Шупика.
1 етап. Запідозрити наявність синдрому Вільямса повинен лікар першого контакту (педіатр, лікар загальної практики, кардіолог, кардіохірург). Перелік клінічних симптомів, які можуть виявлятися у хворих із синдромом Вільямса, представлений у таблиці 2.
Таблиця 2. Структурні та функціональні порушення при синдромі Вільямса
(з рекомендацій Американської педіатричної асоціації)
При підозрі на наявність у пацієнта синдрому Вільямса необхідно проводити наступний перелік обстежень:
- повне фізичне та неврологічне обстеження;
- кардіологічне обстеження з вимірюванням артеріального тиску на всіх кінцівках окремо, та Ехо-КГ;
- УЗД нирок та органів малого тазу;
- дослідження функції нирок (рівень азоту та креатиніну крові);
- уріналізис;
- дослідження рівню кальцію крові та сечі;
- дослідження функції щитоподібної залози;
- офтальмологічне дослідження;
- оцінку психомоторного розвитку.
2 етап. Встановлення клінічного діагнозу лікарем генетиком в обласному медико-генетичному центрі, за направленням лікаря першого контакту. Хоча деякі симптоми синдрому Вільямса мають місце вже при народженні, повний спектр малих аномалій обличчя, що складає враження “обличчя ельфа” та дозволяє поставити клінічний діагноз, як було вже зазначено вище, формується на 3-4-му році життя. Для ранньої діагностики основне значення має оцінка клініко-лабораторних змін. Бальна шкала полегшує встановлення клінічного діагнозу (таблиця 3). При огляді пацієнта в таблиці відмічають наявність симптомів. По кожному розділу підраховують кількість пунктів, що відмічено, та виставляють відповідну кількість балів з визначенням загальної суми.
Таблиця 3. Бальна шкала для клінічної діагностики синдрому Вільямса
В ранньому віці FISH дослідження слід проводити всім дітям з надклапанним стенозом аорти або периферійним стенозом легеневої артерії, незважаючи на відсутність характерного обличчя та психо-когнітивного профілю.
3 етап. Підтвердження клінічного діагнозу синдрому Вільямса за допомогою FISH в спеціалізованому медико-генетичному центрі. Попередньо рекомендується проведення прометафазного цитогенетичного дослідження для виключення складних цитогенетичних перебудов з участю хромосоми 7.
FISH-метод – це вид молекулярної гібридизації нуклеїнових кислот, при якій одним компонентом гібридизації є ДНК фіксованого матеріалу (ДНК про- та метафазних хромосом, а також ДНК інтерфазних ядер), а іншим компонентом – комплементарна їй послідовність ДНК в розчині, помічена флуорохромами (ДНК-зонди). Для діагностики синдрому Вільямса застосовують локус–специфічний ДНК зонд Williams Syndrome Region Probe. Мікроделеція 7q11.2 виявляється у 99% пацієнтів, які мають специфічні клінічні ознаки. Матеріалом для дослідження є периферійна кров пацієнта, взята в стерильний моновет з гепарином.
Лікування:
Як було зазначено вище, причиною розвитку синдрому є мікроделеція, тобто втрата ділянки хромосоми 7. Ця подія відбувається під час кросинговеру в клітинах батьків, і фактори, що її викликають, рівно як і фактори, що дозволять цьому запобігти, на сучасному етапі ще не з’ясовані. Тому, як і для інших хромосомних синдромів етіологічного та патогенетичного лікування синдрому Вільямса на сьогоднішній день не існує.
В той же час адекватне симптоматичне лікування, яке поєднує медикаментозну терапію, хірургічну корекцію вроджених вад розвитку та заходи психо–педагогічної корекції, дозволяє суттєво покращити вітальний та медичний прогноз та досягти значної соціальної адаптації пацієнта в суспільстві.
Діти з синдромом Вільямса потребують проведення ранніх загальнооздоровчих та лікувально–корекційних заходів, які в ранньому віці доповнюються обмеженням вживання вітаміну Д. Рекомендується виключити прийом мультивітамінних комплексів, у зв’язку з тим, що кожен з них включає вітамін Д. Крім того, в деяких випадках, слід обмежити перебування дитини на сонці, для зменшення вироблення вітаміну Д в шкірі під впливом УФ випромінювання. Гіперкальціємія може потребувати в деяких пацієнтів зменшення вживання кальцію з їжею, при цьому важливо проводити моніторинг рівню кальцію, щоб уникнути розвитку ятрогенного рахіту.
Лікувальні заходи в перші роки життя скеровані насамперед на корекцію серцево-судинних порушень та стабілізацію обмінних процесів. Хірургічної корекції надклапанного стенозу аорти потребують приблизно 30% пацієнтів. Летальність при проведенні кардіохірургічного втручання складає 3-7%. Всім хворим з синдромом Вільямса необхідно проводити регулярне вимірювання артеріального тиску окремо на верхніх та нижніх кінцівках (щорічно) та Ехо-КГ (кожні 3-4 роки). Регулярні обстеження необхідні навіть при нормальних базових показниках.
Як було зазначено вище, більшість пацієнтів з синдромом Вільямса мають затримку росту, а кінцеві ростові показники зазвичай нижче 3%. Важливим є контроль росту дітей за таблицями згідно спеціально розробленим стандартам. У кожному випадку затримки росту проводиться визначення рівню гормонів щитоподібної залози та гормону росту з подальшою їх корекцією при необхідності.
Підвищеної уваги та інтенсивного лікування може потребувати хронічне запалення середнього вуха. Порушення прикусу обумовлюють необхідність проведення ортодонтичної корекції.
В зв’язку з підвищеною збудливістю пацієнта необхідність застосовування наркозу виникає не лише при проведенні будь-яких хірургічних маніпуляцій, а навіть, в деяких випадках, при ультразвуковому дослідженні. Необхідно пам’ятати про підвищений ризик раптової смерті при проведенні наркозу у дітей з синдромом Вільямса. Застосування наркозу у таких дітей можливо тільки за участю досвідченого анестезіолога та з забезпеченням можливості проведення термінових реанімаційних заходів.
Особливо важливе значення має рання стимуляція психомоторного розвитку дитини та корекція порушених рухових функцій. У зв’язку з цим показані загальнозміцнюючий масаж та лікувальна фізкультура, що направлені на стимуляцію розвитку статичних та локомоторних функцій. Необхідні також спеціальні вправи, які розвивають тонку моторику пальців рук та зорово-моторну координацію. Необхідно приділяти увагу корекції косоокості – використовуються лінзи, іноді потрібне хірургічне втручання.
Протягом раннього, дошкільного та шкільного віку необхідно стимулювати у дітей пізнавальну активність, розвивати вміння чітко діяти за інструкцією дорослого. Велику увагу під час логопедичних занять слід приділяти розвитку змістової складової мови, при цьому необхідно навчати дитину уникати механічного повторювання та мовної активності, яка позбавлена конкретного змісту. Розробляючи програму занять слід враховувати гарні здібності дітей з синдромом Вільямса до засвоювання навиків читання.
Диспансерний нагляд:
Медичне обслуговування пацієнтів з синдромом Вільямса потребує розуміння динаміки розвитку цього спадкового захворювання, знання потенційно можливих ускладнень та проведення періодичних медичних оглядів. Внаслідок варіабельності клінічних проявів діагноз синдрому може бути не встановлено в ранньому дитячому віці. Слід ще раз наголосити, що клінічний діагноз, встановлений в будь-якому віці потребує підтвердження проведенням FISH, з виявленням мікроделеції 7q11.23.
План диспансеризації хворого з синдромом Вільямса:
- Регулярне медичне обстеження з контролем росто-вагових показників, гостроти зору та слуху.
- Моніторинг рівню артеріального тиску, пульсу на стегновій артерії та щорічне кардіологічне обстеження з проведенням Ехо-КГ (до п’яти років, при нормальних показниках наступне Ехо-КГ на початку пубертату).
- Щорічне проведення сечового скринінгу (уріналізис).
- Контроль рівню кальцію крові – щорічно, якщо в анамнезі були епізоди гіперкальціємії. Якщо первинні показники були в межах норми проведення дослідження кожні 3-4 роки.
- Рівень екскреції кальцію з сечею – дослідження кожні 2 роки.
- Функція щитоподібної залози – обстеження з визначенням рівню гормонів кожні 4 роки.
- Корекція порушень годування в ранньому віці (рефлюксна хвороба, закреп).
- Обстеження іншими фахівцями при наявності показань (ортопед, дитячий невролог, гастроентеролог, нефролог та ін.).
- Ранній початок психо–педагогічних заходів, занять з логопедом, розробка індивідуальної освітньої програми.
Важливим моментом в роботі з родиною, що має дитину з синдромом Вільямса, є забезпечення доступу до друкованої інформації, стосовно синдрому, та інформації в мережі Internet, скерування до відповідних батьківських асоціацій.
Завдання медико-генетичного консультування: 1) індивідуальна оцінка клінічних симптомів та встановлення клінічного діагнозу; 2) визначення ризику повторного народження хворої дитини в родині та ризику для інших родичів; 3) обговорення можливостей реалізації репродуктивної функції у дитини з синдромом Вільямса, 4) обговорення можливих ускладнень з батьками.
Більшість випадків синдрому Вільямса є спорадичними, хоча описано декілька родинних випадків синдрому з успадкуванням хвороби як від матері, так і від батька, причому у всіх цих випадках батьки мали фенотипові ознаки синдрому Вільямса у вигляді особливостей обличчя та інтелектуальної недостатності. Ризик для сибсів при мікроделеції de novo не перевищує 0,5%, ризик для нащадків складає 50%. Репродуктивна функція у пацієнтів з синдромом Вільямса зазвичай не порушена, обмеженням для її реалізації може бути важка ступінь розумової відсталості, або соціальна неадаптованість хворого. В будь-якому випадку батьки або опікуни пацієнта повинні бути попереджені про високий генетичний ризик для нащадків при синдромі Вільямса та необхідність проведення пренатальної діагностики.
Перелік рекомендованої літератури:
- Мостюкова Е.М., Мостовкина А.Г. Основы генетики: Клинико–генетические основы коррекционной педагогики и специальной психологии. Учеб. пособие для студ. пед. высш. учебн. заведений – М.: Гуманит.изд.центр ВЛАДОС, 2001.- 368 с.
- Наследственные синдромы и медико-генетическое консультирование. Атлас-справочник /С.И. Козлова, Н.С. Демикова, Е.Семанова, О.Е.Блинникова.- М.: Практика, 1998.- 416 стр., 392 ил.
- Ворсанова С.Г., Юров Ю.Б., Чернышов В.Н. Хромосомные синдромы и аномалии. Классификация и номенклатура.- Ростов-на-Дону, 1999.- 191 с.
- Бочков Н.П. Клиническая генетика. Учебник для вузов.- М.: ГЭОТАР-МЕД, 2001.- 448 с.
- American Academy of Pediatrics: Health care supervision for children with Williams syndrome.Pediatrics 2001 May;107(5):1192-204.
- Morris CA. Williams syndrome. Gene Clinics: Medical Genetics Knowledge Base (http://www.geneclinics.org).
Переглянуто редакційною колегією I.B.I.S.: 28/10/2005
Дивіться також:
- Синдром Вільямса (інформація для спеціалістів)
- Синдром Вільямса (інформація для батьків)
- Синдром Вільямса (діаграми розвитку дітей)
Синдром Вільямса
(Williams Syndrome)
Любов Степанівна Євтушок
Зав. медико-генетичною консультацією
Рівненського обласного клінічного лікувально-діагностичного центру
Включення:
Синдром ідіопатичної інфантильної гіперкальціємії, синдром “обличчя ельфа”.
Діагностичні критерії:
- Дизморфії обличчя: “ельфоподібне” обличчя;
- Серцево-судинні аномалії в 70% випадків (найчастіше надклапанний аортальний стеноз (НАС) або легеневий периферичний стеноз);
- Гіперкальціємія;
- Розлади поведінки (гіперчутливість до шуму або музики, гіпертрофована соціальність);
- Мала маса тіла при народженні;
- Затримка росту, низький зріст;
- Мальформації та порушення функції нирок;
- Дрібні, рідко розміщені зуби;
- Мікроделеція 7q11.23.
Клінічна характеристика:
Черепно-лицеві дизморфії: великий лоб, збільшені надбрівні дуги, косоокість, райдужка ока блакитна з світлими вкрапленнями (“зірчаста”), короткі очні щілини, епікант, повні щоки, широка верхня щелепа, товста нижня губа і довгий фільтр, мала нижня щелепа, великий відкритий рот, кирпатий ніс.
Найпоширенішим серцевим порушенням є надклапанний аортальний стеноз та легеневий периферичний стеноз, в 50% спостерігаються дефекти перегородок серця. Може бути стеноз ниркової артерії з гіпертензією.
Наявність таких рис у дитини має змусити лікаря продовжити дослідження на наявність синдрому Вільямса. Діти з синдромом Вільямса мають низький зріст, малу масу тіла при народженні. Постнатальний ріст відповідає 75% від нормального. Помірна мікроцефалія.
Відставання у розумовому розвитку помірне (IQ в 55-60). У когнітивному плані діти з синдромом Вільямса є дуже особливими, що виражається у невідповідності між дещо уповільненим розвитком мовлення та затримкою розвитку здатності орієнтуватись у просторі, що стає помітним з перших років життя дитини. Діти віком старше 3 років мають знижену здатність до адаптації, часто мають поганий настрій, не вміють концентрувати увагу. Це в свою чергу відображається на навчанні дітей в дошкільних виховних закладах. Ось чому діагноз у більшості випадків встановлюється на 3-6 році життя малюка. Такі діти мають навчатись у спеціалізованих закладах чи за спеціальними програмами. Хворі на синдром Вільямса гіперчутливі до шуму і звуку. Характерні для них надмірна балакучість і любов до музики.
У приблизно 10% випадків пацієнти мають ідіопатичну неонатальну гіперкальціємію, що є причиною блювання, закрепів, анорексії, поліурії, полідипсії, а також, якщо це продовжується до дорослого віку, і нефрокальцинозу. Діти можуть мати порушення розвитку зубів (гіпоплазія емалі, часткова адонтія), кифосколіоз, довгу шию, пахові або пупкові кили, вальгусну деформацію першого пальця стопи. У деяких випадках діти мають хриплий голос, косоокість, підвищений рівень холестерину, гіпопластичні нігті.
У дорослому віці пацієнти також не можуть бути повністю самостійними. Для них характерні артеріальна гіпертензія, рекурентні інфекції сечовивідних шляхів, ожиріння, хронічні закрепи, жовчнокам’яна хвороба. Для багатьох з них в деяких країнах створено центри допомоги, де вони проводять свій вільний час та працюють.
У 95% випадків діагноз підтверджується наявністю мікроделеції 7q11.23.
Ускладнення:
Ускладненням при синдромі Вільямса може бути раптова смерть при загальній анестезії. Головними її причинами вважається стеноз коронарних артерій та важка форма обструктивного бівентрикулярного порушення відтоку крові.
Методи діагностики:
Діагностика ґрунтується на виявленні мікроделеції 7q11.23 за допомогою флуоресцентної гібридизації in-situ (FISH).
Пренатальна діагностика:
Якщо в ураженого батька (матері) була виявлена мікроделеція, то можливе проведення інвазивних методів пренатальної діагностики. Цей метод також можна порадити у випадках, коли батьки вже мали дитину, уражену синдромом.
Диференційна діагностика:
Діагностування синдрому Вільямса не є складним за умови наявності всіх ознак синдрому, особливо кардіопатії. У випадку відсутності вад серця діагноз можна встановити, проаналізувавши наявність черепно-лицевих дизморфій, розумового відставання та розладів поведінки, а також провівши дослідження на мікроделецію. Наявність ізольованого надклапанного аортального стенозу ще не дозволяє встановити діагноз синдрому Вільямса, тому що існують декілька споріднених типів надклапанного аортального стенозу з аутосомно-домінантним типом успадкування.
Диференційний діагноз слід проводити з ідіопатичною інфантильною гіперкальціємією без лицевих і серцевих аномалій, підклапанним аортальним стенозом.
Етіологія:
Більшість випадків синдрому Вільямса були спорадичними. Але в світовій літературі задокументовані і випадки передачі синдрому від батьків дітям. Нещодавні дослідження показали, що і спорадичні випадки, і успадковані є результатом делецій одного з алелів еластину, що розміщений в хромосомній ділянці 7q11.23.
Частота виникнення: біля 1 випадку на 20000-25000 новонароджених.
Співвідношення статі: Ч1 : Ж1.
Нагляд та лікування:
Єдиним чисто медичним підходом є лікування вад серця. Іноді доводиться втручатися хірургам. Щодо іншого, то у дитини потрібно розвивати психомоторику, ортофонію та соціальні здібності.
При необхідності застосування загальної анестезії необхідно провести превентивні заходи, спрямовані на запобігання артеріальній обструкції, підвищенню артеріального тиску, порушенню функції нирок та кальцієвого гомеостазу і його впливу на міокард.
Генетичне консультування:
Ризик виникнення синдрому у дитини батьків, що вже мали нащадка з синдромом Вільямса, є дуже невеликим. Але він зростає, якщо хоча б один з батьків має це захворювання. За останній час було описано декілька випадків виникнення синдрому Вільямса з аутосомно-домінантним типом успадкування. У таких випадках ризик мати дитину з синдромом Вільямса дорівнює 50%.
Невирішені питання та коментарі:
Лабораторне підтвердження не є повністю досконалим, але воно покращиться з покращенням техніки виявлення мікроделецій. Нещодавно були виявлені нові форми синдрому, діагностика яких є значно складнішою. Вважається, що вони є наслідками менших делецій. На даний час відомі, принаймні, два гени, що відповідають за виникнення цього синдрому: ELN (еластин) та LIMK1 (лімкіназа). Ведеться робота над визначенням інших генів.
Номер з каталогу МІМ:
194050 Williams-Beuren Syndrome; WBS.
Література:
- Козлова С.И., Демикова Н.С., Семанова Е., Блинникова О.Е. Наследственные синдромы и медико-генетическое консультирование.- М.: Практика, 1996.- С. 54-55.
- Маринчева Г.С., Гаврилов В.И. Умственная отсталость при наследственных болезнях.– М.: Медицина, 1988.- С. 15-28.
- Jones KL. Smith’s Recognizable Patterns of Human Malformation. W.B. Saunders Company, Philadelphia 1997:117-118.
- Williams-Beuren Syndrome; WBS. OMIM # 194050.
Переглянуто редакційною колегією I.B.I.S.: 19/05/2003
Дивіться також:
- Синдром Вільямса (методичні рекомендації)
- Синдром Вільямса (інформація для батьків)
- Синдром Вільямса (діаграми розвитку дітей)
Пухлина Вільмса
(Wilms Tumor)
С. Клочкова
Лікар УЗД
Рівненського обласного онкологічного диспансеру
Нефробластома (пухлина Вільмса 1) – високо злоякісна ембріональна пухлина нирки.
Клініка:
Клінічна картина пухлини Вільмса залежить від стадії захворювання, наявності метастазів і віку захворювання. Зазвичай ураженою є лише одна нирка – 86%, у 6% хворих пухлина двобічна і у 8% хворих спостерігаються множинні пухлини.
На ранніх стадіях захворювання клінічні прояви пухлини досить бідні і частіше виражаються в слабкості, поганому самопочутті, схудненні, зниженні апетиту, періодичному субфібрилітеті, помірній анемії, прискоренні ШОЕ. На пізніх стадіях ПВ специфічною ознакою є новоутвір в животі, який пальпується. При пальпації пухлина рухлива, майже безболісна, щільна чи еластична, гладка чи горбкувата, кулеподібна чи неправильної форми. При великих розмірах пухлина викликає асиметрію живота і визначається на відстані, значно відтісняє в протилежну сторону всі суміжні органи і тканини.
На пізніх стадіях проявляється:
- Болем, причиною якого є тиск на навколишні органи чи проростання пухлини в діафрагму, печінку чи заочеревинну клітковину.
- Гематурією:
- Макрогематурією у 10-12% дітей.
- Мікрогематурія зустрічається частіше за все.
- Анемією, асцитом.
- Артеріальною гіпертензією (відмічалась лише у 60% хворих). При цьому систолічний тиск, зазвичай, коливався в рамках 110–140 мм рт ст., діастолічний тиск – 90-100 мм рт ст.
Пухлина відносно рано може метастазувати, як лімфогенним, так і гематогенним шляхом. Найбільш часта локалізація метастазів (MTS):
- Заочеревинні лімфовузли – 60%;
- Печінка – 10%;
- Кістки – 5%;
- Легені – 25%.
Асоційовані аномалії:
Ризик ПВ підвищується в асоціації з декількома характерними синдромами вроджених аномалій, хоча ці випадки складають менше, ніж 5% усіх випадків ПВ. У дітей, хворих на нефробластоми, були виявлені також такі аномалії:
- Порушення функції сечостатевої системи складають 28% від всіх аномалій, що супроводжують пухлину Вільмса; їх знаходять у 3,9% всіх хворих.
- Пухлина Вільмса також може бути пов’язана за своїм походженням з синдромом гемігіпертрофії. Клінічні ознаки включають асиметрію тіла. Гіперпластичні процеси росту ряду органів і тканин присутні в клініці синдрому і призводять до злоякісної трансформації клітин.
- Синдром Беквіта–Відемана (екзофтальм, макроглосія, гігантизм, вісцеромегалія) поєднується з гемігіпертрофією; вірогідність неопластичних процесів складає 25%.
- Синдром WAGP проявляється анірідією, вадами сечостатевої системи, розумовою відсталістю. Дослідження показали, що ці хворі мають делецію короткого плеча хромосоми 11, яка завжди включає район 11р13.
- На даний час гену WT1 відводять важливу роль у формуванні синдрому Деніса–Драша, який характеризується аномаліями розвитку статевих органів, вродженою нефропатією і розвитком ПВ.
Діагностика:
При підозрі на ПВ необхідно провести комплексне обстеження, використовуючи рентгенологічний, радіоізотопний, ультразвуковий методи, ангіографію. Найбільш специфічним методом для діагностики ПВ є екскреторна урографія, яка може підтвердити наявність пухлини, її розміри і частково поширеність. УЗД – дозволяє виявити об’ємний тканинний утвір в нирці, провести диференційну діагностику з кистозним утвором. Комп’ютерна томографія черевної порожнини і заочеревинної ділянки є одним з найточніших методів виявлення ПВ, оцінки стану регіональних лімфовузлів і навколишніх органів та тканин. Гістологічне дослідження найбільш достовірно визначає прогноз.
Для виявлення метастазів використовується:
- Рентгенографія грудної клітки та черепа (метастази в легенях та в кістках черепа);
- Радіоізотопне сканування скелету (метастази в кістках);
- УЗД черевної порожнини і радіоізотопне сканування печінки.
Одним із напрямків підвищення ефективності ранньої діагностики ПВ є пошук специфічних маркерів цієї пухлини. Найперспективнішими вважається визначення тканинного поліпептид-специфічного антигена (ТПСА), який є сироватковим маркером пухлинної активності. У хворих на ПВ його рівень достовірно підвищений порівняно з хворими з доброякісними новоутворами нирок та зі здоровими. Вміст ТПСА у сироватці хворих на ПВ знижується в процесі лікування. Цілком перспективне і викликає зацікавлення використання генетичних прогностичних маркерів ПВ.
Етіологія:
Пухлина Вільмса (ПВ) є унікальною пухлиною, оскільки значно частіше, ніж інші пухлини дитячого віку, асоціюється з вродженими вадами розвитку і генетичними синдромами.
Сімейні випадки зустрічаються дуже рідко. Вони складають 1-3% і мають аутосомно-домінантний тип успадкування з неповною пенетрантністю.
За розвиток ПВ відповідальні порушення в декількох генах: WT1, WT2, WT3. Ген WT1 був ідентифікований в 1989 році. Він локалізований на хромосомі 11р13 і відповідає за формування специфічних білків, які беруть участь в регулюванні розвитку первинного нефрону. В нормі продукти гена WT1 виступають в якості регулятора розвитку нирки і супресора пухлинного росту. Окрім гена WT1 на хромосомі 11р13 був ідентифікований ген WT2, а на хромосомі 16 – ген WT3.
Крім виявлених порушень у визначених генах, в останні роки важливу роль у розвитку ПВ відводять дизрегуляції фетальних мутагенів, підвищенню експресії гена інсуліноподібного фактора росту 2. Ненормальна активація цього фактора була виявлена у половини обстежених на ПВ.
Роль генетичного фактора в розвитку ПВ підтверджує також її часта асоціація з вадами розвитку інших органів і систем. Встановлено, що мутації в гені WT1 призводять не лише до ПВ, але також проявляються різними аномаліями сечостатевих органів, анірідією (вродженою відсутністю райдужної оболонки), вродженою гемігіпертрофією.
Механізм канцерогенезу нефробластоми інтенсивно вивчався при декількох генетичних синдромах, при яких існує схильність до розвитку ПВ.
Гермінальні мутації є причиною менш, ніж 5% пухлин Вільмса. Більшість випадків ПВ є спорадичними.
За даними літератури, білатеральні пухлини частіше є сімейним явищем і виникають внаслідок 2 мутацій: 1 гермінальної та 1 соматичної. Спорадичні пухлини виникають внаслідок 2 соматичних мутацій.
Близько 20% сімейних випадків – білатеральні, близько 3% спорадичних випадків – білатеральні.
Генне картування:
Для WT1 – локус 11p13; для WT2 – локус 11р15.5; WT3 – 16q; WT4 – 17q12-q21; WT5 – 7р15–р11.2.
Вік прояву:
Зустрічається у дітей віком до 6 років.
Частота:
1:10000 новонароджених. Пухлина Вільмса – одна з найбільш частих солідних пухлин в дитячому віці і становить біля 8% випадків раку в дитячому віці.
Співвідношення між статями: практично однакове.
Диференційна діагностика:
Диференційну діагностику ПВ необхідно проводити з:
- Простою кистою нирки;
- Гідронефрозом;
- Полікистозом;
- Тромбозом ниркової вени.
Найбільші труднощі в доопераційному періоді виникають з диференційною діагностикою ПВ з іншими новоутворами нирки, такими як доброякісна фетальна мезодермальна гамартома, ангіоміоліпома, злоякісна аденокарцинома.
Лікування:
Завжди комплексне: хірургічне лікування і хіміотерапія. Післяопераційна радіотерапія проводиться для всіх хворих на ПВ на стадіях ІІ, ІІІ, ІV, а також дітям зі стадією І, старших 2 років. Дози радіотерапії у значній мірі залежать від віку дитини.
Результати лікування:
Число вилікуваних хворих з І і ІІ стадіями складає близько 90%; з ІІІ стадією – 70%; з IV стадією – до 60%.
Ризик виникнення рецидивів ПВ після проведеного лікування 14-20%. Дворічне виживання у хворих з рецидивами ПВ не перевищує 43%.
Генетичне консультування:
Основними завданнями медико–генетичного консультування сімей, у яких є діти з нефробластомою, є:
- Виявлення спадково–детермінованих форм ПВ;
- Визначення прогнозу для родичів хворого і його нащадків;
- Формування диспансерних реєстрів, що включають осіб з підвищеним ризиком розвитку пухлини;
- Організація диспансерного нагляду.
Переважним методом диспансеризації дитини віком до 8 років є УЗД органів черевної порожнини.
Номер з каталогу МІМ:
194070 Wilms Tumor 1; WT1.
Література:
- Beheshti M, Mancer JRK, Hardy BE, et al. External Genital Abnormalities Associated with Willms Tumor. Urology. 1984; 24:13-133.
- Breslov NE, Beckwith JB. Epidemiological Features of Wilm’s Tumor: Results of the National Wilm’s Tumor Study. J. Natl. Cancer. Inst. 1982; 68:429.
- Brodeur GM. Genetic and Cetogenetic Aspects of Wilms’ Tumor. In: Wilms’ Tumor Clinical and Biological Manifestations. Eds. C. Pochedly, E.S. Baum. New York. Elsevier. 2001: 125-145.
- D’Angio GJ, Evans A, Breslow N, et al. The Treatment of Wilms’ Tumor: Results of the Second National Wilms’ Tumor Study. Cancer. 1981; 47:2302.
- Giangiacomo J, Kissane JM. Congenital Wilms’ Tumor. In: Wilms’ Tumor. Clinical and Biological Manifestations. Eds. C.Pochedly, E.S.Baum. New York. Elsevier. 1984: 103-108.
- Giangiacomo J, Penchansky L, Moteleone PL, et al. Bilateral Neonatal Wilms’ Tumor with B-C Chromosomal Translocation. J.Pediatr. 1975, 86:98.
- Greenwood MF, Holland P. Clinical and Biomedical Manifestations of Wilms’ Tumor. In: Wilms’ Tumor. Clinical and Biological Manifestations. Eds. C. Pochedlym, E.S.Baum. New York. Elsevier. 1984: 9-30.
Переглянуто редакційною колегією I.B.I.S.: 13/08/2004
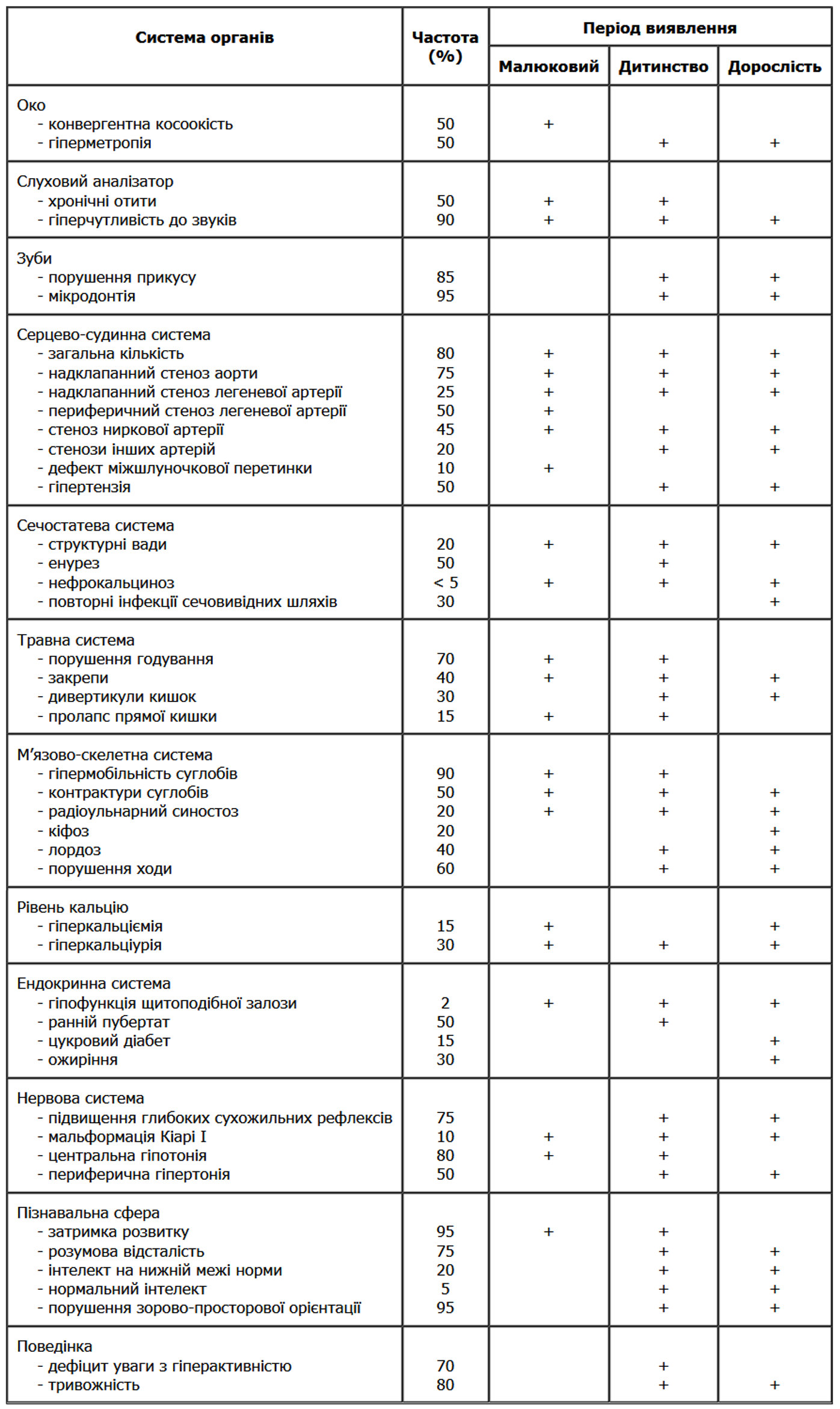
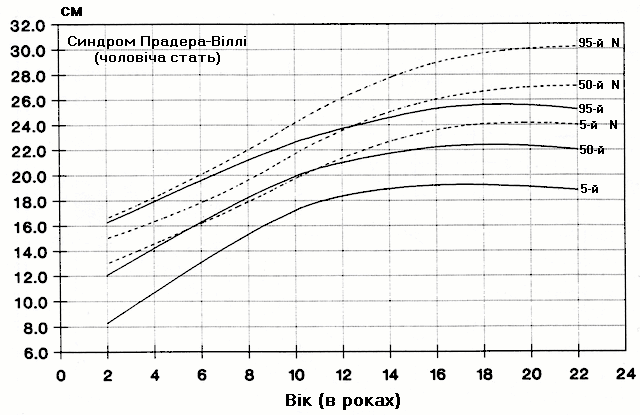
Синдром Прадера-Віллі – довжина стопи
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”.
Стандартизовані криві довжини стопи (95-й, 50-й та 5-й персентилі) у осіб з синдромом Прадера-Віллі (42 хлопчики і 29 дівчат) порівнюються з нормою (N). Було обстежено пацієнтів з видимою цитогенетичною делецією (52%), нормальним каріотипом (37%) та невідомим хромосомним статусом (11%). Приблизно половина обстежених пацієнтів була на низькокалорійній дієті. Деяки пацієнти спостерігались протягом 6 років. Butler MG and Meaney FJ: Pediatrics 88:853, 1991. Copyright © 1991 Reproduced by permission of Pediatrics.