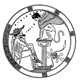
Serhiy
Синдром Фрімана-Шелдона
(Freeman-Sheldon Syndrome)
О.М. Мислінчук
Лікар-генетик
Рівненської обласної медико-генетичної консультації
Включення:
Синдром обличчя людини, що свистить.
Визначення:
Синдром Фрімана-Шелдона – це дуже рідкісне генетичне захворювання з переважним ураженням обличчя та опорно-рухового апарату.
Діагностика:
Більшість ознак синдрому є вторинними по відношенню до підвищеного м’язевого тонусу. Для синдрому характерно:
З боку обличчя:
- високе чоло, маскоподібне обличчя; малий рот обумовлює вигляд “обличчя людини, що свистить”;
- глибоко посаджені очі, широке перенісся, телекант, епікант, страбізм;
- малий ніс, гіпоплазовані крила носа з колобомами, довгий фільтр;
- мікроглосія, мікрогенія, Н-подібні шкірні ямочки на підборідді;
- високе піднебіння;
- обмеження рухів м’якого піднебіння з гнусавою мовою.
Кістково-суглобові ознаки:
- ульнарна девіація пальців китиць (91%);
- флексія пальців (88%);
- потовщення шкіри згинальної поверхні проксимальних фаланг китиць;
- еквіноварусна деформація та контрактури І пальця ступні (59%);
- вертикальне положення таранної кістки;
- кіфосколіоз (84%);
- контрактури кульшових та/або колінних суглобів (74%);
- клишоногість;
- часткова синдактилія;
- камптодактилія.
Інше:
- постнатальна затримка росту;
- пахова кила;
- крипторхізм;
- втрата слуху;
- розумовий розвиток у більшості пацієнтів в межах норми.
Поєднання з іншими ВВР:
- мікроцефалія (44%);
- розумова відсталість (31%);
- судоми (19%);
- пласке обличчя;
- птоз;
- мала вага при народженні;
- вроджений вивих стегна;
- прихована спинно-мозкова кила.
Лабораторні дослідження:
На даний час не існує тестів, за допомогою яких можна діагностувати синдром Фрімана-Шелдона.
Диференційний діагноз:
Зазвичай, диференційний діагноз проводять з синдромом обмеженого розкривання рота (аутосомно-домінантний тип успадкування), який, на відміну від синдрому Фрімана-Шелдона, характеризується відсутністю еквіноварусної позиції ступнів, поступовим прогресуванням захворювання, характерними порушеннями флексорики.
Етіологія:
У більшості випадків синдром має аутосомно-домінантний тип успадкування, але в деяких випадках зустрічається аутосомно-рецесивне успадкування. Цей синдром може також з’являтись спорадично і без сімейної історії.
Патогенез:
Неодноразово різні вчені намагались з’ясувати патогенез синдрому (P. Macleod, H. Patriquin, 1974), (I. Lauk, 1974). На думку цих авторів, зміни м’язів обличчя можуть бути пов’язані з гіпоплазією моторної частки лицевого нерва. Припустимо, що ульнарна девіація пальців також обумовлена патологією ліктьового нерву (ураження моторних нейронів). Це дозволяє оцінити значну частину змін при синдромі Фрімана – Шелдона як наслідок нервово – м’язових порушень.
Співвідношення статей: Ч1 : Ж1.
Вік маніфестації:
Синдром Фрімана-Шелдона можна запідозрити при народженні, хоча деякі його прояви (сколіоз та ін.) можуть з’явитись пізніше. Проблеми з вигодовуванням (блювота, зригування, аспірація) відмічаються лише в ранньому віці, але з віком вони зменшуються.
Лікування:
У плані лікування в залежності від наявності тих чи інших проявів синдрому пропонують такі заходи:
- ортопедична чи пластична корекція кистей рук, ступнів, рота;
- черепно-лицьова хірургія для зміни форми лобної кістки;
- фізіотерапія для покращання функції руки та здатності ходити;
- заняття з логопедом.
Профілактика:
Медико-генетичне консультування.
Номер з каталогу МІМ:
193700 Whistling Face-Windmill Vane Hand Syndrome.
Література:
- Jones KL. Smith’s Recognizable Patterns of Human Malformations. W.B.Saunders Company, Philadelphia. 1997:214-216.
- Warkany J. Congenital malformations:. Notes and comments. Year Book Publisher, Chicago. 1981:673-674.
- Козлова С.И., Демикова Н.С., Семанова Е., Блинникова О.Е. Наследственные синдромы и медико – генетическое консультирование. М.: Практика, 1996.- C.127-128.
- Тератология человека /Под ред. Г.И. Лазюка.- M.: Медицина, 1979.- C.381-383.
Переглянуто редакційною колегією I.B.I.S.: 15/02/2002
Cерпоподібно-клітинна анемія – зріст дівчат
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”
Дані отримані в результаті обстеження 133 пацієнтів (62 дівчинки, решта хлопчики) з серпоподібно-клітинною анемією (62,4% гомозиготний серпоподібний гемоглобін, 37,6% варіативна гемоглобінопатія). Середні показники ±1 стандартне відхилення накладаються на нормальні (зафарбовані) ділянки. Phebus CK et al: J Pediatr 105:28, 1984.
Тріхо-ріно-фалангеальний синдром, тип 1
(Trichorhinophalangeal Syndrome, Type І)
С.О. Поліщук
Лікар-генетик
Волинського обласного дитячого територіального медичного об’єднання
Синоніми:
- TRP Syndrome;
- TRPS І.
Основні діагностичні критерії:
Грушевидний ніс, рідке волосся, конічні епіфізи.
Частота:
Дуже рідкісний синдром. Був вперше описаний Klingmuller в 1956 році, хоча згадувався раніше. Гідеон доповнив і запропонував назву тріхо-ріно-фалангеальний синдром.
Клінічна характеристика:
Голова і шия. Виступаючий довгий фільтр, мікрогнатія, грушевидний ніс з розширеним кінчиком, брови широкі з рідкою або відсутньою латеральною частиною, вії короткі, великі відстовбурчені вуха, тонкі губи, карієс зубів, порушення прикусу, дефекти емалі.
Зріст. Помірна затримка зросту від 3 до 10 персентилей.
Шкіра, нігті, волосся. Тонкі нігті, койлоніхія, лейконіхія. Волосся тонке, рідке, дуже повільно росте, січеться, легко випадає, особливо в лобно-вискових ділянках. Інколи до 12-16 років розвивається облисіння. Діаметр волосяного стержня значно зменшений, можливі аномальні кутікули клітин. Відмічається гіпоплазія сосочків волосяних фолікулів при добре розвиненому волосяному матриксі.
М’язово-скелетна система. Клінобрахідактилія, можливі ульнарна девіація вказівного, середнього пальця і радіальна девіація 4-5 пальців кистей. Дистальні фаланги перших пальців кистей і стоп є короткі. Можливі вкорочення усіх пальців. Зустрічається асептичний некроз головок стегнових кісток, плоскоступість, гіперрухливість суглобів.
Рентгенологічні обстеження:
Конічні епіфізи найчастіше знаходять в середніх і менш часто в проксимальних фалангах 2, 3 і 4 пальців кистей. В 50% випадків зустрічається проксимальне вкорочення метакарпальних кісток 5 і 4 пальців кистей. Можливі множинні конічні епіфізи пальців стоп, сколіоз, лордоз, криловидні лопатки, кілевидна грудна клітка. В 50% випадків знаходять Легга-Пертеса-подібні зміни в кульшових суглобах, однак з більш серйьозними ускладненнями. Можливі дегенеративні артрити хребта, кульшових суглобів, колінних і ліктьових суглобів, вивихи колінних та зап’ясткових суглобів, вкорочення ліктьової кістки, сірінгоміелія, ранній синостоз зон росту.
Неврологічна симптоматика:
Загальна м’язева гіпотонія в ранньому дитинстві, нормальний інтелект.
Поєднані симптоми:
Часті респіраторні інфекції, вроджені вади серця, пролапс мітрального клапана, хвороби нирок, полікістоз яєчників, помірна розумова відсталість, пігментні невуси.
Етіологія:
В більшості випадків аутосомно-домінантний тип успадкування, однак описані сім’ї з аутосомно-рецесивною передачею. Синдром зумовлений делецією в регіоні 8q24.11.
Генне картування:
Ген (TRPSІ – zince finge transcription factor) локалізований на 8q24.11. Мутації такого ж гена знаходять у випадках тріхо-ріно-фалангеального синдрома, тип ІІІ.
Співвідношення статі: не має статевої переваги.
Диференціальний діагноз:
Ізольовані конічні епіфізи, ключично-краніальна дисплазія, де Ланге синдром, Еліса-ван-Кревельда синдром, хрящів-волосся гіпоплазії синдром, псевдогіпопаратіреоїдизм, Легга-Пертеса синдром, тріхо-ріно-фалангеальний синдром, тип ІІ.
|
Ознаки
|
TRP І
|
TRP ІІ
|
|
Часті респіраторні інфекції
|
+
|
–
|
|
Тонке волосся
|
+
|
–
|
|
Великі відстовбурчені вуха
|
+
|
–
|
|
Грушевидний ніс
|
+
|
–
|
|
Виступаючий довгий фільтр
|
+
|
–
|
|
Тонка верхня губа
|
+
|
–
|
|
Мікрогнатія
|
+
|
–
|
|
Клінобрахидактилія
|
+
|
–
|
|
Конічні епіфізи кистей
|
+
|
–
|
|
Криловидні лопатки
|
+
|
–
|
|
Низький зріст
|
+
|
–
|
|
Додаткові ознаки TRP ІІ:
|
|
|
|
Множинні екзостози
|
–
|
+
|
|
Надлишок шкіри в новонароджених
|
–
|
+
|
|
Гіперрухливість суглобів
|
–
|
+
|
|
Мікроцефалія
|
–
|
+
|
|
Затримка розумового розвитку
|
–
|
+
|
|
Затримка розвитку мови
|
–
|
+
|
|
Шкіряні невуси
|
–
|
+
|
Прогноз: сприятливий, середня тривалість життя.
Лікування:
Симптоматичне. Лікування хвороби Легга-Пертеса, якщо її діагностують, можливе за допомогою хірургічної корекції деформацій кінцівок.
Номер з каталогу МІМ:
190350 Trichorhinophalangeal Syndrome, Type I; TRPS1.
Література:
- Bauermeister S, Letts M. The orthopaedic manifestations of the Langer-Giedion syndrome. Orthop Rev. 1992 Jan;21(1):31-5.
- Beals RK. Tricho-rhino-phalangeal dysplasia. Report of a kindred. J Bone Joint Surg Am. 1973 Jun;55(4):821-6.
- Besser F, Wells RS. The tricho-rhino-phalangeal syndrome (a family with three affected members). Br J Dermatol. 1976 Jul;95 Suppl 14:39-41.
- Buhler EM, Malik NJ. The tricho-rhino-phalangeal syndrome(s): chromosome 8 long arm deletion: is there a shortest region of overlap between reported cases? TRP I and TRP II syndromes: are they separate entities? Am J Med Genet. 1984 Sep;19(1):113-9.
- Burgess RC. Trichorhinophalangeal syndrome. South Med J. 1991 Oct;84(10):1268-70.
- Ferrandez A, Remirez J, Saenz P, Calvo M. The trichorhinophalangeal syndrome. Report of 4 familial cases belonging to 4 generations. Helv Paediatr Acta. 1980 Dec;35(6):559-67.
- Hou J, Parrish J, Ludecke HJ, Sapru M, Wang Y, Chen W, Hill A, Siegel-Bartelt J, Northrup H, Elder FF, et al. A 4-megabase YAC contig that spans the Langer-Giedion syndrome region on human chromosome 8q24.1: use in refining the location of the trichorhinophalangeal syndrome and multiple exostoses genes (TRPS1 and EXT1). Genomics. 1995 Sep 1;29(1):87-97.
Переглянуто редакційною колегією I.B.I.S.: 13/11/2002
Cерпоподібно-клітинна анемія – вага дівчат
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”
Дані отримані в результаті обстеження 133 пацієнтів (62 дівчинки, решта хлопчики) з серпоподібно-клітинною анемією (62,4% гомозиготний серпоподібний гемоглобін, 37,6% варіативна гемоглобінопатія). Середні показники ±1 стандартне відхилення накладаються на нормальні (зафарбовані) ділянки. Phebus CK et al: J Pediatr 105:28, 1984.
Синдром Сотоса
(Sotos Syndrome)
О.С. Ціж
Лікар-генетик медико-генетичної консультації
Рівненського обласного клінічного лікувально-діагностичного центру
Включення:
Синдром церебрального гігантизму.
Основні діагностичні критерії:
Надлишковий зріст і маса тіла (збільшені), акромегалія (розумова відсталість, “порушення координації”).
Клінічна картина:
Макросомія маніфестує внутрішньоутробно, середня маса тіла новонародженого – 3,9 кг, довжина 55,2 см. У більшості випадків зріст з перших місяців життя перевищує 90-й перцентиль, а до року – 97-й. У наступні 4-5 років темпи росту залишаються прискореними, пізніше знижуються до нормальних. Зріст дорослих хворих відповідає верхній межі норми або трохи перевищує її. Маса тіла пропорційна зросту.
Надлишковий зріст поєднується зі збільшенням розмірів голови (макроцефалія у 100%, особливо лобних бугрів 96%), нижньої щелепи, а також кистей і стоп. Відмічається деякий надлишок підшкірно-жирової клітковини на дистальних відділах кінцівок. Кістковий вік, як і зубний, випереджає паспортний, однак, прискорений ріст і акромегалоїдні риси не зумовлені надлишковою продукцією соматотрогенного гормону або інших відомих ростових факторів. Гормональний статус хворих відповідає їх віку.
Характерними дизморфіями є доліхоцефалія, грубі риси обличчя, гіпертелоризм, антимонголоїдний розріз очей, виступаюча нижня щелепа, готичне піднебіння. Зустрічаються також макроглосія, лицева плетора, страбізм, сколіоз, синдактилія ступнів, пігментні плями, гамартоми, вроджені вади серця.
Рентгенологічно виявляється нахилене до заду турецьке сідло.
При пневмоенцефалографії – розширення шлуночків мозку без підвищення внутрішньочерепного тиску.
У хворих відмічають помірно виражену затримку психічного розвитку з елементами агресивності. Розумова відсталість найчастіше відповідає ступеню легкої дебільності і не прогресує. Мова уповільнена, експресивна.
Відмічаються судоми, загальний тремор, порушення координації, особливо тонких рухів. Зміни на ЕЕГ не специфічні.
Етіологія і патогенез:
Невідомі. Вважають, що нові домінантні мутації є основною причиною захворювання. Вказують на можливість неповної пенетрантності гена. Не виключена також генетична гетерогенність синдрому.
Співвідношення статей: Ч1 : Ж1.
Тип успадкування:
Аутосoмно-домінантний, більшість випадків спорадичні.
Популяційна частота:
Невідома. Сотос описав у 1964 році 5 пацієнтів і пізніше повідомлялось ще про 105 таких випадків.
Вік маніфестації:
Синдром можна запідозрити вже при народженні, але найчастіше діагноз ставиться в 2-3 роки.
Лікування:
Лікування високорослості недоцільне у зв’язку з позитивним прогнозом.
Прогноз:
Тривалість життя не знижується.
Медико-генетичне консультування:
У спорадичних випадках генетичний ризик для сибсів низький. Враховуючи можливість неповної пенетрантності, необхідне уважне обслідування сім’ї. Генетичний ризик для потомства високий, але відносно сприятливий прогноз не дає підстав для рекомендацій по обмеженню дітонародження.
Диференційний діагноз:
XXY-синдром, синдром Відемана-Беквіта, синдром Вівера.
Номер з каталогу МІМ:
117550 Sotos Syndrome.
Література:
- Беникова Е.А., Бучилевская Т.И., Елльванская Е.М. Генетика эндокринных заболеваний.- К.: Наукова думка, 1993.
- Козлова С.Н., Демикова Н.С., Семанова Е., Блинникова О.Е. Наследственные синдромы и медико-генетическое консультирование.- М.: Практика, 1996.
Переглянуто редакційною колегією I.B.I.S.: 11/02/2002
Cерпоподібно-клітинна анемія – зріст хлопчиків
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”
Дані отримані в результаті обстеження 133 пацієнтів (71 хлопчик, решта дівчатка) з серпоподібно-клітинною анемією (62,4% гомозиготний серпоподібний гемоглобін, 37,6% варіативна гемоглобінопатія). Середні показники ±1 стандартне відхилення накладаються на нормальні (зафарбовані) ділянки. Phebus CK et al: J Pediatr 105:28, 1984.
Серповидно-клітинна хвороба
(Sickle Cell Disease)
С.Ф. Лапченко
Інформаційний спеціаліст
Волинського ОМНІ-центру
Що таке серповидно-клітинна хвороба?
Ця хвороба являє собою спадкове захворювання крові, яке викликає напади болю, пошкодження життєво важливих органів і, часом, смерть в дитинстві або в юнацькому періоді. Серповидно-клітинна хвороба (СКХ) уражає протеїн, що знаходиться в червоних клітинах крові. Цей протеїн називають гемоглобіном. Хвороба виникає тоді, коли людина успадковує два гена СКХ або один ген СКХ і ще один аномальний ген, який діє на червоні клітини крові.
Гемоглобін виконує важливу функцію в організмі, він переносить кисень з легень до всіх частин людського тіла. Саме його зміна і викликає симптоми серповидно-клітинної хвороби. В нормі червоні клітини крові є округлі і гнучкі. У людей з СКХ вони, віддавши кисень, деформуються, стають схожими на твердий банан або серп, закриваючи прохід в кровоносних судинах.
Деформовані клітини виловлюються і знищуються в печінці і селезінці, в результаті чого загальна кількість червоних клітин в крові знижується, викликаючи анемію. Якщо цей процес заходить дуже далеко, – хворий стає блідим, починає задихатися і дуже швидко стомлюється. Певні стани (наприклад, інфекції) погіршують анемію, прискорюючи процес знищення червоних клітин крові або зменшуючи їх виробництво.
Серед форм СКХ найчастіше зустрічаються серповидно-клітинна анемія (SS хвороба) та серповидна “С” хвороба. Рідше трапляється серповидна бета-таласемія. Прояви хвороби залежать від організму людини і у кожного вони різні. Деякі люди рідко звертаються до лікарів з приводу симптомів СКХ, інші ж часто потрапляють до лікарні.
Які специфічні проблеми мають діти з серповидно-клітинною хворобою?
Діти з СКХ дуже вразливі до бактеріальних інфекцій, таких, наприклад, які викликають менінгіт та пневмонію. Це є основною причиною смерті дітей, хворих на СКХ. Однак, рання діагностика та відповідне лікування значно зменшують ризик таких інфекцій і смертність від них. Дослідження доводять, що лікування, розпочате в перші 4 місяці життя і триваюче до 5 років, знижує ризик розвитку серйозних інфекцій на 85%.
Дуже важливо для хворих дітей отримати всі необхідні протягом дитинства щеплення. Одне з них, HIB-щеплення (Hemophilus Influenzae B), рекомендовано всім дітям, починаючи з 2-х місяців життя, воно захищає їх від інфекції, що викликає деякі форми менінгіту. Інша, пневмококова вакцина, запобігає виникненню пневмонії і пневмококового менінгіту. Також необхідно пам’ятати про щеплення від гепатиту В та грипу.
Що викликає напади болю у хворих СКХ?
З часом, серповидні клітини злипаються в невеликих судинах. В цьому випадку вони блокують їх, перекриваючи надходження крові до навколишніх тканин, а значить і надходження життєво необхідного для них кисню. Без кисню ця ділянка починає боліти. Якщо блокада триває довго, тканини гинуть.
Процес блокування кровоносних судин при серповидно-клітинній хворобі називається “больовою кризою”. Криза може бути дуже сильною і в цьому випадку вимагає госпіталізації, вона може бути м’якою і людина може лікуватися вдома.
На сьогоднішній день немає ефективних ліків, щоб попередити або зупинити процес деформування червоних клітин крові, що викликає больову кризу.
Чи можливо заразитися серповидно-клітинною хворобою?
Ні. Ця хвороба не заразна, вона є спадковою. Щоб захворіти, дитина повинна успадкувати два гени СКХ, по одному від кожного з батьків-носіїв.
Чи може жінка з СКХ мати дітей?
Жінки з серповидно-клітинною хворобою можуть мати нормальну вагітність. Проте, вони мають підвищений ризик виникнення різних ускладнень, які можуть вплинути як на здоров’я матері, так і дитини. Під час вагітності прояви хвороби можуть стати тяжчими, а больові кризи – частішими. У вагітних жінок з СКХ частіше трапляється невиношування вагітності та народження дітей з малою вагою тіла. Однак, ранній пренатальний догляд і ретельний моніторинг під час вагітності значно збільшують можливість народження здорових дітей.
Чи можливо виявити носія хвороби?
Існує тест, який називається електрофорез гемоглобіну. За його допомогою можна визначити, чи людина хвора чи є носієм СКХ (без проявів хвороби), а також багатьох інших спадкових захворювань крові. Є також і пренатальний тест, який дозволяє дізнатись, чи плід матиме СКХ, чи буде носієм або повністю здоровим після народження. Якщо обидва батьки мають ген СКХ, то в 3 із 4 випадків тест покаже, що плід не буде мати серповидно-клітинної хвороби.
Чи існують ліки від серповидно-клітинної хвороби?
Є багато нових ідей, які можуть одного дня призвести до можливості повного виліковування від СКХ. Сьогодні ж ще не знайдено препарата або метода, який би міг поправити аномальний ген або запобігти больовим кризам. Проте, існують багато методів зменшення тяжкості і частоти виникнення криз. Також намітився певний прогрес в медичному догляді хворих на СКХ, що зменшує заподіяну організму шкоду. Такий догляд значно поліпшив виживання і якість життя багатьох хворих на серповидно-клітинну анемію.
Переглянуто редакційною колегією I.B.I.S.: 15/02/2002
Дивіться також:
Cерпоподібно-клітинна анемія – вага хлопчиків
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”
Дані отримані в результаті обстеження 133 пацієнтів (71 хлопчик, решта дівчатка) з серпоподібно-клітинною анемією (62,4% гомозиготний серпоподібний гемоглобін, 37,6% варіативна гемоглобінопатія). Середні показники ±1 стандартне відхилення накладаються на нормальні (зафарбовані) ділянки. Phebus CK et al: J Pediatr 105:28, 1984.
Хвороба Тея-Сакса
(Tay-Sachs Disease)
Є. Ларіончик
Молодший науковий співробітник
Інституту геронтології АМН України
Що таке хвороба Тея-Сакса?
Хвороба Тея-Сакса – це спадкове захворювання центральної нервової системи. Найбільш поширена форма його спостерігається у немовлят. Уражені діти при народженні виглядають здоровими і, як здається, в перші кілька місяців життя розвиваються нормально. Далі розвиток уповільнюється і виникають симптоми. На жаль, ефективного лікування для цих дітей не існує. У них відсутній фермент (білок), що зветься гексозамінідаза А і є необхідним для розщеплення певних жирових речовин у мозку та нервових клітинах. Ці речовини накопичуються в тканинах і поступово руйнують мозок та нервові клітини, доки вся центральна нервова система не припиняє свою роботу. Симптоми класичної хвороби Тея-Сакса вперше з’являються у віці 4-6 місяців, коли зовнішньо здорова дитина раптово припиняє посміхатися, повзати або перевертатися, втрачає здатність брати речі та утримувати їх в руці і врешті-решт стає сліпою, паралізованою і не реагує на зовнішній світ. Смерть настає у віці до 5 років.
Хто має ризик народження дитини з хворобою Тея-Сакса?
Найчастіше хвороба Тея-Сакса зустрічається серед нащадків центрально- та східноєвропейських євреїв Ашкеназі. Приблизно один із 30 американських євреїв є носієм гену Тея-Сакса. Деякі особи неєврейського походження – нащадки французьких канадців (що походять зі Східного Квебеку – долини річки Св. Лаврентія ), а також члени популяції Кайєн (теж нащадки французьких емігрантів) у штаті Луїзіана, теж наражаються на підвищений ризик. У цих групах населення частота хвороби Тея-Сакса у 100 разів вища, ніж в інших етнічних групах. Проте, частота ювенільної форми хвороби (що вражає молодих людей) може не бути вищою в цих групах.
Як передається хвороба?
Тільки спадковим шляхом. Людина-носій має один нормальний ген гексозамінідази А та один «неправильний» ген хвороби Тея-Сакса. У носія немає ознак захворювання, і він живе здоровим та повним життям. Проте, коли двоє носіїв вступають у шлюб, ризик, що будь-який з їхніх дітей успадкує по 1 гену Тея-Сакса від кожного з батьків і буде хворим, дорівнює 1 випадок на 4 народження. Шанс, що дитина успадкує від кожного з батьків по 1 нормальному гену і буде повністю здорова, теж дорівнює 1:4. І, нарешті, ймовірність того, що дитина успадкує два різних гени і буде здоровим носієм, як її батьки, становить 2:4. Якщо тільки один з батьків є носієм, жодний з їхніх дітей не має ризику хвороби, але кожен з них має 50% ризик успадкування єдиного гену Тея-Сакса, тобто ризик здорового носійства.
Чи є якісь інші форми хвороби Тея-Сакса, крім класичного її типу, що вражає немовлят?
Класичний дитячий тип захворювання є найбільш поширеним. Проте, існують інші рідкісні варіанти дефіциту гексозамінідази А, які деколи відносять до хвороби Тея-Сакса. Найчастіше це ювенільна форма (симптоми виникають у молодому віці), хронічна форма та форма дорослого віку. В уражених осіб спостерігається низька концентрація гексозамінідази А в організмі, тоді як при класичній дитячій формі захворювання цей фермент взагалі відсутній. Це може пояснити, чому симптоми при такому варіанті виникають пізніше і зазвичай є менш важкими. У дітей з ювенільною формою дефіциту гексозамінідази А між 2 і 5 роками життя з’являються ознаки хвороби, що нагадують класичну дитячу форму. Незважаючи на те, що перебіг хвороби є більш повільним, смерть звичайно настає до 15 років життя. Симптоми хронічного дефіциту гексозамінідази А також можуть виникати у віці до 5 років, але вони є значно легшими, ніж при дитячій та ювенільній формах. Розумові здібності, зір та слух залишаються неушкодженими; проте, може спостерігатися уповільнена мова, м’язова слабкість, судоми, тремор (тремтіння) кінцівок, нестійка хода та, деколи, патологія психіки. В осіб з «дорослою» формою дефіциту гексозамінідази А спостерігаються багато з тих симптомів, що мають місце при хронічній формі, але вони з’являються пізніше.
Чи існують якісь методи лікування хвороби Тея-Сакса?
Трагічно, але лікування не існує, і жоден з методів нездатний запобігти прогресу захворювання. Ураженим дітям можна допомогти тільки шляхом створення якомога комфортніших умов.
Чи може хвороба Тея-Сакса бути діагностована до народження дитини?
Так. Пренатальні (допологові) тести, які називаються амніоцентез та біопсія ворсин хоріону (БВХ), допоможуть це зробити. При амніоцентезі, який зазвичай здійснюється між 15 та 18 тижнями вагітності, через стінку живота матері вводиться спеціальна голка, щоб взяти пробу рідини, яка оточує плід. Ця рідина містить клітини плода, які можна досліджувати на наявність гексозамінідази А. При БВХ лікар отримує пробу клітин або через тонку трубку, яку він вводить крізь піхву та шийку матки до плаценти, або шляхом введення голки крізь стінку живота матері. Плацента містить клітини, що є генетично ідентичними з клітинами плода, які зручно досліджувати на наявність гексозамінідази А. БВХ зазвичай роблять між 10 та 12 тижнями вагітності. Якщо тест показує, що гексозамінідаза А присутня, то дитина не страждатиме на хворобу Тея-Сакса. Якщо вона відсутня, то дитина буде хвора. В незвичайних випадках ДНК-діагностика допоможе визначити, чи у плода класична дитяча форма хвороби Тея-Сакса, чи інший тип дефіциту гексозамінідази А, а також, якщо можливо, наскільки важко хворітиме дитина. Інші підходи, що використовуються при заплідненні “в пробірці” (генетичне тестування ембріонів для того, щоб до матки переносилися тільки здорові зародки), ще досліджуються, але їх безпечність та надійність і досі не визначені.
Як люди можуть дізнатися про те, чи є вони носіями гену Тея-Сакса?
Ви можете пройти тест, що вимірює кількість гексозамінідази А у Вашій крові. У носіїв гену Тея-Сакса концентрація ферменту вдвічі нижча, ніж у тих, у кого немає цього гену, але її цілком достатньо для потреб організму. Проба крові також може бути використана для проведення ДНК-діагностики, при якій визначаються відомі мутації (зміни) в гені гексозамінідази А, які, власне, і викликають чотири форми хвороби. Цей тест рекомендують, якщо результати звичайного скринінгу на носійство, що був обговорений вище, є нечіткими. ДНК-тести також можна використосувати для діагностики пізніх, «дорослих» форм хвороби Тея-Сакса. На жаль, в Україні такі методики ще не впроваджені досить широко.
Де можна пройти тести на носійство хвороби Тея-Сакса?
Скринінг (обстеження зовнішньо здорових осіб) на носійство гену Тея-Сакса можна пройти в генетичних центрах або клініках. Про їх місцезнаходження Вас може інформувати Ваш лікар. Генетичні центри проводять скринінг-тести, які допомагають визначити, чи є хтось із партнерів або обидва партнери носіями гену Тея-Сакса. Досвідчені генетики-консультанти пояснять Вам результати тесту, і Ви таким чином будете інформовані щодо ризику наявності даного захворювання у Ваших дітей.
Які проводяться дослідження щодо хвороби Тея-Сакса?
Дослідження допомогли ідентифікувати різноманітні мутації в гені гексозамінідази А, що є причиною рідкісних форм дефіциту цього ферменту. Отримана інформація про певні мутації допомагає вдосконалити діагностику та скринінг на носійство всіх форм хвороби Тея-Сакса. Також проводяться численні дослідження з генної терапії, коли дослідники переносять нормальний ген до клітин з метою заміни ушкодженого або відсутнього гену. Цей революційно новий підхід до лікування зараз досліджується на групах хворих з важкими генетичними розладами. Якщо він виявиться ефективним, він може також дати певну надію дітям з хворобою Тея-Сакса.
Переглянуто редакційною колегією I.B.I.S.: 15/02/2002
Псевдоахондроплазія – зріст
Із українського перекладу книги “Growth References: Third Trimester to Adulthood. Compiled by Saul RA, Geer JS, Seaver LH, Phelan MC, Sweet KM, Mills CM. Greenwood Genetic Center. 1998”
Зріст осіб з псевдоахондроплазією порівнюється з показниками розвитку (зафарбована ділянка) здорових осіб (разом хлопчики і дівчата). Дані отримані в результаті обстеження 61 пацієнта (28 хлопчиків та 33 дівчат). Horton WA et al: Am J Dis Child 136:316, 1982.