Ірина Гогоша
Аутосомний домінантний полікістоз нирок
(Autosomal Dominant Polycystic Kidney Disease)
Діана Рафаелівна Ахмеджанова
Інформаційний спеціаліст
Хмельницького ОМНІ-Центру
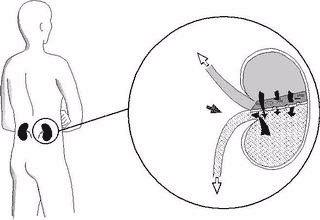
Нирки – це парні органи бобовидної форми, розмірами з кулак, зазвичай 11 см у довжину. Вони розташовані у задній частині черевної порожнини по обидві сторони від хребта. Нирки складаються приблизно з 1 млн. маленьких канальців або нефронів, та функціонують як фільтри, підтримуючи правильний баланс хімічних речовин і мінералів, фільтруючи відходи з крові. Порушення функцій нирок можна визначити за допомогою вимірювання концентрації продуктів життєдіяльності у крові.
Рис.1. Нирки та їх місцезнаходження
Полікістоз нирок (ПКН) – рolycystic kidney disease (PKD) – це спадкове захворювання, що характеризується множинними гронами мішкоподібних утворень, що наповнені рідиною, які з часом призводять до збільшення розмірів нирок та порушення їх функції. Ці кісти руйнують ниркову тканину. ПКН може призвести до хронічної ниркової недостатності.
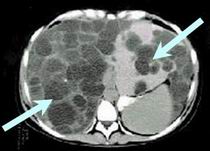
При полікістозі кісти розвиваються в обох нирках. Кісти можуть мати розмір з головку шпильки або досягати розміру грейпфруту. Коли розвиваються множинні кісти, нирки можуть збільшитись до розміру м’яча чи більше.
Залежно від типу успадкування вирізняють дві форми:
- Аутосомний домінантний полікістоз нирок (АДПКН) – або полікістоз нирок “дорослого типу”, є найбільш поширеним серед спадкових хвороб, що становлять загрозу для життя.
- Аутосомний рецесивний полікістоз нирок (АРПКН) – хвороба, що зустрічається відносно рідше і є причиною високої смертності у перші місяці життя.
Що таке кісти?
Кіста в нирці починається як випинання нефрону, подібно до пухиря. Кісти можуть з’являтися у будь-якому місці вздовж нефрону. Хоча під полікістозом розуміють утворення багатьох кіст, вони формуються не в кожному нефроні. Вміст кісти залежить від тієї частини нефрону, у якій вона виникла.
Приблизно 70 відсотків кіст відділяються від нефрону тоді, коли вони ще дуже маленькі, приблизно 2 мм в діаметрі. З часом кісти збільшуються і наповнюються прозорою рідиною чи рідиною, що містить кров та білі кров’яні клітини.
Кісти також можуть утворюватись в інших органах, найчастіше в печінці. Сучасні дослідження висувають припущення, що кісти печінки більше асоціюються з жовчним протоком або канальцями печінки, а не з власне клітинами печінки. Виявляється, що замість того, щоб займати місце функціонуючих клітин печінки, кісти тільки виштовхують клітини печінки назовні. Ось чому кісти печінки не спричиняють печінкової недостатності, навіть якщо розмір печінки може значно збільшитись внаслідок утворення кіст.
Дослідження показали, що існують принаймні три компоненти утворення кіст:
- Проліферація клітин: клітини стінки кісти відтворюються у більшій кількості, ніж нормальні клітини нирок, що і спричиняє збільшення кісти.
- Клітинна секреція: секреція – це шлях утворення рідини. Для того, щоб утворити кісту, самі клітини мають виробляти рідину. Якщо рідина для наповнення кісти не утворюється, утворюється куля з клітин.
- Порушення базальної мембрани: базальна мембрана – це дуже тонкий шар тканини, де знаходяться кістозні клітини. При АДПКН цей шар товстіший, ніж звичайно і утворюється неправильно.
Зазвичай, проблеми, спричинені кістами, пов’язані з розмірами кіст та їх локалізацією. Розмір нирок та печінки прямо пропорційно залежить від кількісті та розмірів кіст. Наприклад, з більшою ймовірністю біль виникне у людей, розміри нирок яких більше 15 см, ніж у людей із меншими розмірами нирок.
Кісти часто важко помітити за допомогою медичних приладів до досягнення пацієнтом 30 років. Типовими ранніми симптомами є біль у спині з того чи іншого боку, періодичні інфекції сечової системи, або кров у сечі. Іншим особам може бути поставлений діагноз, коли вони проходять обстеження з приводу високого тиску, або після проведення ультразвукового обстеження черевної порожнини з інших причин.
Рис.2. Здорова та полікістозна нирки
Чому я ніколи не чув/чула про полікістоз нирок? Це нова хвороба?
У XVIII–XIX ст. полікістозу нирок часто присвоювали назву “Хвороба Брайта”. Цей термін охоплював кілька захворювань нирок, що визначалися високою концентрацією протеїну у сечі. Сьогодні ми знаємо, що багато випадків хвороби Брайта – це насправді випадки полікістозу нирок. Перший задокументований випадок ПКН датований часом правління Стефана Батори (Bathory), короля Польщі (1533-1588 рр.).
До того ж, Фундація ПКН, єдина організація у світі, що займається ПКН, була утворена лише у середині вісімдесятих років. Лише нещодавно ПКН отримав поштовх до більш активного вивчення та утворення фондів цієї хвороби.
Іншою причиною того, що мало хто чув про ПКН, є те, що це “внутрішній розлад” – тобто він не спричиняє серйозного впливу на зовнішній вигляд особи. Особа з ПКН може страждати від болю, чи мати травму внутрішніх органів і при цьому мати “нормальний” зовнішній вигляд, що не привертає увагу і не викликає співчуття оточуючих.
Генетичні аспекти
АДПКН є спадковим захворюванням, отже це означає, що воно має перейти від одного з батьків до дитини шляхом генетичного успадкування. Кожна людина має 23 пари хромосом, що містять генетичну інформацію (тобто гени). Одна з пар хромосом визначає стать, решта 22 пари хромосом відомі як аутосоми, що містять решту генів. Оскільки ген АДПКН є аутосомним, він однаково вражає як чоловіків, так і жінок.
Часто у великих родинах, де відомо, що кілька членів мали хворобу, за допомогою аналізу крові можна визначити осіб, що мають це захворювання. Для аналізу необхідно отримати свіжі зразки крові як хворих, так і здорових членів родини. Гени досліджуються на генні варіації або, інакше кажучи, генетичні маркери АДПКН. Далі проводиться аналіз генетичного зчеплення, що має 2-5% похибку, оскільки діагностика проводиться на рівні генних варіацій та генних маркерів.
Успадкування АДПКН
Кожна дитина від батьків з АДПКН має шанс 50% успадкувати цю хворобу. Також було виявлено, що приблизно 10% пацієнтів з ПКН захворіли внаслідок спонтанної мутації, а не шляхом успадкування. Шанси захворіти на АДПКН не залежать від статі, віку, раси чи етнічного походження.
Ядро кожної клітини містить хромосоми, в яких міститься необхідна інформація для формування і функціонування організму. Хромосоми в свою чергу складаються з генів, що є основними одиницями спадковості. Вони залишаються невидимими навіть під електронним мікроскопом. Гени вивчаються молекулярними генетиками.
Мета лікування генетично успадкованого захворювання – це виявити аномальний протеїн і спробувати виправити цю ситуацію. Однією з найдивніших речей, що нам відомі – це те, що причиною АДПКН є не один ген. Існують принаймні три гени, що спричиняють АДПКН. Приблизно у 80% пацієнтів з АДПКН виявлено ген АДПКН1, що знаходиться на 16 хромосомі. У решти пацієнтів ген АДПКН2 розташований на 4 хромосомі. Розташування гену АДПКН3 поки не визначено.
Виявляється, що захворювання, спричинені генами АДПКН1 та АДПКН2, мають певні відмінності. При наявності гена АДПКН1 захворювання перебігає важче: раніше формуються кісти, підвищується артеріальний тиск та розвивається ниркова недостатність.
Якщо дідусь чи бабуся має АДПКН, а мати чи батько не мають, чи можу я мати цю хворобу?
ПКН не пропускає поколінь. Однак, симптоми та прогредієнтність хвороби не обовязково проявляються в кожному поколінні однаково.
Ген АДПКН є домінантним – це означає, що достатньо одного зразка гена від матері чи батька. При домінантному гені стану носія не існує; він не зникає і проявляєтся потім у наступних поколінь. Отже, якщо особа має цей ген, то в певний період життя хвороба все одно проявиться. Коли у особи немає гену АДПКН, а отже, немає і хвороби, то особа не може передати ген наступному поколінню.
При АДПКН також існує 10% імовірності спонтанної мутації. Це означає, що замість того, щоб успадкувати ген АДПКН від батьків, ген мутує самостійно з невідомих причин. Важливо знати, що навіть у випадку справжньої спонтанної мутації хвора особа все одно передасть мутований ген своїм дітям.
У будь-якої особи з АДПКН в одній родині присутній той самий тип гену АДПКН і той самий дефект гену. Однак, навіть у межах однієї родини ознаки, симптоми і перебіг хвороби часто відрізняються. Дуже важко передбачити хід хвороби у будь-якого члена родини виходячи з прогредієнтності хвороби у батьків, братів чи сестер цієї особи.
Медико-генетичне консультування
МГК має на меті допомогти хворим особам та особам, що знаходяться у групі ризику, краще зрозуміти спадкову природу хвороби, отримати інформацію щодо діагностики, успадкування і ризиків для особи та родини. Не всі потребуватимуть консультації, але у певні періоди життя вона може стати у пригоді, наприклад, для отримання більшої інформації, чи планування сім’ї.
За допомогою аналізу генетичного зчеплення можна з високою точністю визначити наявність чи відсутність хвороби у інших членів родини або у ненародженої дитини. Однак для цього тесту потрібні зразки крові та ультразвукове обстеження хоча б двох інших хворих та двох здорових членів родини.
Ознаки та симптоми АДПКН
Які симптоми АДПКН? Проблеми, пов’язані з АДПКН
Зараз аутосомний домінантний полікістоз нирок вважається більше ніж звичайним нирковим розладом. Також можуть бути ураженими і інші органи. Весь перелік проблем, що описані нижче, спостерігається тільки у невеликої кількості людей.
Часто захворювання діагностується випадково з приводу обстеження з інших причин. На ранній стадії хвороби (до 30 років) симптоми не проявляються. Фактично, у багатьох випадках діагноз АДПКН не ставиться на основі незначних або відсутніх симптомів. Часто першою ознакою АДПКН є високий тиск, кров у сечі чи відчуття важкості/болю у спині, боці, чи животі. Іноді першою ознакою є запалення сечових шляхів та/або камені у нирках.
Найбільш поширеною проблемою при АДПКН є хронічний біль. Зазвичай, біль відчувається у спині, боці та, іноді, у животі, може бути непостійним та слабким. Лише у невеликої кількості людей біль може бути постійним та досить сильним.
Підвищення артеріального тиску
На підвищення артеріального тиску, або гіпертонію, страждають від 60 до 70% людей з АДПКН. Він з’являється на ранній стадії АДПКН. Найбільш імовірною причиною високого тиску при АДПКН є звуження судин внаслідок тиску кіст, що призводить до зменшення кров’яного потоку до деяких частин нирки. Сенсори у нефроні реагують таким чином, ніби тиск у нирках низький; починає вироблятись ренін, який стимулює утворення ангіотензіну, що звужує судини і спричиняє підвищення тиску. Якщо гіпертонію не лікувати, то це може призвести до пошкодження нирок, збільшення серця та призвести до нападів.
Кісти у печінці
У 60–70% хворих на АДПКН протягом життя з’являються кісти у печінці. Кісти у печінці рідко з’являються до 30 років, але формуються і збільшуються з віком. Хоча спостерігається збільшення розміру печінки, кількість функціональних тканин печінки залишається незмінною. Кісти у печінці виявляються однаково часто як у чоловіків, так і у жінок. Хоча у жінок кісти з’являються у більш ранньому віці. Також у жінок утворюється більше кіст та вони більші за розміром. У жінок, що були вагітними, спостерігається більша схильність до кіст у печінці; у цих жінок кіст більше та вони більші за розміром, ніж у жінок, що не були вагітними.
Рис.3. Кісти у нирках та печінці
Інфекції сечових шляхів
Зазвичай, запалення починається у сечовому міхурі і може поширитись на сечоводи та нирки. Хоча запалення сечових шляхів спостерігається як у чоловіків, так і у жінок, у жінок запалення спостерігається частіше. Основним симптомом є біль чи печіння при сечовипусканні та/або сильне бажання мочитися, хоча сечі дуже мало. Коли запалення спостерігається у нирках чи кістах, може мати місце несподіваний напад чи жар, лихоманка та біль у спині чи боці. У жінок часто спостерігаються запалення сечового міхура, що мають назву цистит, навіть у тих випадках, коли вони не хворіють на полікістоз нирок. Будь-яке запалення сечових шляхів у чоловіків та виявлення циститу більше трьох разів у жінок вже само по собі вимагає обстеження. Пацієнти, у родинній історії яких виявлявся полікістоз, мають обстежитись раніше.
Гематурія (кров у сечі)
Виявляється у 50% пацієнтів з АДПКН. Масивні домішки крові виявляються візуально, а незначні їх кількості (мікрогематурія) виявляються тільки за допомогою спеціальних аналізів сечі. Сеча може бути червоною, коричневою, чи мутною. Гематурія може тривати кілька днів, чи рідше, кілька тижнів, але сеча обов’язково очищується сама по собі, часто без лікування. Причиною вважається пошкодження маленьких кровоносних судин у нирках у результаті збільшення кіст. Іноді крововилив може відбуватись прямо у кісту. Цим може пояснюватись біль та підвищення температури.
Камені у нирках
Камені у нирках виявляються у 20% пацієнтів з АДПКН, хоча причини цього невідомі. Однією з причин такого поширення можливо є блокування кістами канальців, що заважає нормальному дренуванню. Коли сеча залишається у певній ділянці довше, ніж слід, можуть сформуватись кристали і спричинити утворення каменів. Інша причина утворення каменів у людей з АДПКН – зменшення цитрату у сечі. Сечовий цитрат – це речовина, що перешкоджає утворенню каменів. Камені можуть бути різними за розміром, різними за хімічною структурою, гладкими, чи нерівними. Клінічні симптоми визначаються розміром та положенням каменів. Симптомами каменів у нирках є сильний біль у спині, боці чи паху. Часто буде спостерігатись кров у сечі. Іноді маленькі камені можуть виходити без будь-яких проблем чи дискомфорту, але великі камені можуть спричинити закупорку (обструкцію) нирок та/або біль.
Зниження ниркової функції
Вважається, що збільшення розмірів та кількості кіст частково перешкоджає нормальному функціонуванню нирок і викликає незворотні ушкодження. Нещодавно в результаті деяких досліджень було зроблено припущення, що запалення нирок та наступні рубці у відповідь на запалення також можуть призвести до зниження ниркової функції. Це відбувається не без впливу шкідливих речовин у крові. Ступінь ушкодження є різним і може тривати багато років. Більшість пацієнтів із порушенням функції нирок та АДПКН можуть жити нормальним життям, незважаючи на втрату навіть 90% функцій. При прогресуванні ниркової недостатності необхідний гемодіаліз.
Фактично, третина пацієнтів досягає віку 70 років без ниркової недостатності. Неможливо передбачити, у кого вона виникне, але за допомогою регулярного лікарського спостереження можна визначити ступінь прогресування хвороби та зробити деякі прогнози на майбутнє.
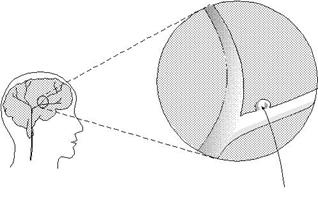
Аневризми
Іншою важливою проблемою є аневризми кровоносних судин (аневризми Беррі). Аневризма – випинання стінки судини, зазвичай це має місце у кровоносних судинах головного мозку.
Спостерігається збільшення (за нещодавніми оцінками на 10%) випадків виявлення аневризм у родинах, де спостерігався АДПКН, та принаймні в одного із родичів був субарахноїдальний крововилив. Високий кров’яний тиск спричиняє підвищення тиску на судинну стінку, а відтак збільшується ризик її розриву. У випадках розриву аневризми симптомами можуть бути раптовий сильний головний біль, біль при рухах шиї, нудота та блювота, і навіть втрата свідомості. Ці симптоми вимагають термінового медичного втручання.
Таким чином, контроль за артеріальним тиском є дуже важливим. При виявленні аневризм для попередження крововиливу у майбутньому можна вдатися до операції.
Рис.4. Аневризма Беррі у мозку
Пролапс мітрального клапана
Пролапс мітрального клапана – це стан, за якого клапан, що відділяє ліве передсердя від лівого шлуночка, закривається неповністю. Іноді це є причиною того, що кров повертається у верхню частину серця. Цей стан має назву регургітації; її можна почути під час обстеження серця, коли у серці є шуми. Пролапс мітрального клапана зустрічається приблизно у 26% людей з АДПКН порівняно із 2–3% загальної кількості населення. З пролапсом асоціюються прискорене серцебиття, відчуття, що серце вискакує, б’ється занадто часто, і біль у грудях, не спричинений вправами чи зусиллями.
Кили
У хворих на АДПКН зустрічаються як пахові, так і пупкові кили.
Дивертикульоз
Дивертикульоз – це випинання ободової кишки. Складається враження, що у осіб з АДПКН, що застосовували діаліз чи трансплантацію, дивертикульоз виявляється частіше і спостерігається більше ускладнень, включаючи запалення, ніж у людей з іншими хворобами нирок.
Хоча у кожної особи з геном АДПКН розвиваються кісти у нирках, не у кожного хвороба прогресує до ниркової недостатності, а якщо і прогресує, то рідко до 40 років.
Подолання болю при АДПКН
Чи можна позбавитись болю хірургічним шляхом?
Є деякі попередні результати застосування лапароскопічної хірургії для так званого “зняття верхівки” кісти, і, таким чином, полегшення болю пацієнтів. Лапароскопія схожа на артроскопію; для процедури необхідний дуже малий надріз, і необхідно значно менше часу на післяопераційне відновлення та рубцювання. Ця процедура проводиться тільки для тих пацієнтів, чиї симптоми переконливо свідчать про те, що біль спричинений кістами, і в кого кісти більше 5 мм в діаметрі. Процедура тільки полегшує біль, а не зберігає ниркові функції.
Чи можна контролювати біль за допомогою ліків?
Виявляється, що жодний анальгетик не можна застосовувати без побічних дій. Кодеїн та інші наркотичні засоби призводять до залежності. Нестероїдні протизапальні речовини (аспірин, ібупрофен, напроксин) та деякі інші можуть призводити до зменшення потоку крові через нирки та підвищення кров’яного тиску – отже, пацієнти з ПКН НЕ ПОВИННІ приймати ці препарати. Ацетамінофен можливо вживати у невеликих кількостях і протягом нетривалого часу, але пацієнти з хронічним сильним болем повинні проконсультуватись щодо альтернативних методів лікування.
Хронічна ниркова недостатність та АДПКН
Яка імовірність того, що у пацієнта з ПКН розвинеться ниркова недостатність?
Більше ніж у 60% осіб з ПКН розвивається хронічна ниркова недостатність, прийнятним лікуванням якої є діаліз і трансплантація. Однак, на даний момент не існує ані лікування, ані ліків від ПКН.
Прогресування до хронічної ниркової недостатності у людей з АДПКН, зазвичай, відбувається поступово. Хронічна ниркова недостатність – це стан, за якого нирки більше не можуть виводити відходи і зайву воду та підтримувати баланс електролітів і кислот у крові. Це проявляється:
- Зниженням активності
- Слабкістю
- Обмеженням дихання
- Втратою ваги
- Нудотою і/або блюванням
- Металевим присмаком у роті
- Легкою або середньою депресією
- Зниженням розумових здібностей
Діагностика АДПКН
Для лікаря ознаками можливої наявності АДПКН є наступне: повідомлення про АДПКН в історії родини, ознаки та симптоми, що часто зустрічаються при АДПКН, або в ході обстеження з інших причин в нирках були виявлені кісти.
На даний момент існують три основних клінічних тести, що застосовуються для діагностики полікістозу нирок: УЗД, комп’ютерна томографія (КТ) чи магнітно- резонансна томографія (МРТ).
Найбільш надійним дослідженням є ультразвукове обстеження нирок. Маленькі кісти можна не побачити, але треба пам’ятати, що кісти розвиваються з віком. Таким чином, у випадку молодших пацієнтів, відсутність кіст не обов’язково свідчить про те, що хвороба не була успадкована. Багато лікарів не радили б скринінг сім’ї на предмет АДПКН до досягнення 25 років. У ситуаціях, коли існують сумніви, більш детальну картину можна отримати за допомогою рентгенівського сканування, що називається комп’ютерною томографією (КТ). Магнітно-резонансна томографія (МРТ) схожа на комп’ютерну томографію, але замість рентгенівських променів тут використовуються магнітні хвилі. МРТ-сканування добре підходить для обстеження кровоносних судин мозку і може бути використане як один з варіантів виявлення аневризм.
Причиною того, що в якості першого тесту не застосовується комп’ютерна томографія (КТ) є те, що при КТ використовується радіація і часто вимагається контрастування. КТ є найкращим тестом тоді, коли є підозри на певні ускладнення, наприклад, кровотечі у кісті чи камені у нирках. Обмеженням застосування як УЗД, так і КТ є те, що для того, щоб побачити кісти, вони мають бути достатньо великими.
На даний момент тест зчеплення генів є найбільш точним у тому випадку, коли кісти не можна побачити ані за допомогою УЗД, ані за допомогою комп’ютерної томографії. Зчеплення генів може визначити стан АДПКН у родинах з імовірністю 99%. Однак, тест на зчеплення генів досить дорогий; для цього тесту також необхідні зразки крові інших членів родини з АДПКН. Через це зчеплення генів зазвичай застосовується в тому випадку, коли недіагностований член родини хоче стати донором нирки для іншого члена родини, або якщо позитивний результат плоду може вплинути на результат вагітності.
Існує кілька методик здійснення цього тесту. Два найбільш поширених методи здійснення аналізу ДНК – тестування зчеплення та секвенування. Тестування зчеплення не є прямим аналізом послідовності генів ПКН1 та ПКН2 у ДНК. Дане дослідження базується на визначенні певних “маркерів” у ДНК кількох членів родини, де був поставлений діагноз ПКН. Для аналізу необхідно отримати зразок крові особи, що тестується (пробанд), та зразки крові кількох (трьох чи більше) осіб більше ніж з одного покоління родини пробанда, включаючи здорових та хворих на АДПКН. Також необхідна детальна історія родини та родовід. Зазвичай результати аналізу повідомляються усім членам родини, що здавали кров.
На відміну від попереднього, для тесту прямого секвенування ДНК необхідний лише один зразок від пробанда. Він є конфіденційним і результати повідомляються тількі пацієнту та його лікарю. За допомогою дуже складного апарату аналізується кожна із 17000 “основ” ДНК і, таким чином, визначається уся послідовність. Це єдиний вихід у тому випадку, якщо інші члени родини не можуть або не бажають прийняти участь у тестуванні.
Лікування АДПКН
Що таке діаліз?
Методи лікування ниркової недостатності включають гемодіаліз та перитонеальний діаліз. Гемодіаліз – це процедура виведення зайвої рідини, електролітів та відходів за допомогою апарату в домашніх умовах чи у діалізному центрі. Перитонеальний діаліз – це метод діалізу, за якого виводиться зайва рідина, електроліти та відходи використовуючи очеревину. Існують два види перитонеального аналізу: безперервний амбулаторний перитонеальний діаліз, що робиться на постійній основі із замінами 4 рази на день, та безперервний циклічний перитонеальний аналіз – діаліз, що робиться уночі за допомогою апарату, заміни відбуваються під час сну.
Що таке трансплантат?
Це пересадка здорової нирки донора, що бере на себе функцію хворих нирок. Трансплантація – краще довготермінове лікування, ніж діаліз. Досвід показує, що після трансплантації пацієнти з АДПКН зазвичай почувають себе добре. У багатьох випадках трансплантовані нирки функціонували добре протягом 10-20 років, іноді нирки відмовляють раніше. Завдяки сучасним лікам, що пригнічують відторгнення трансплантованої нирки, 75-80% трансплантованих нирок відповідно функціонують щонайменше 5 років. Було розроблено багато нових препаратів, і є надія, що вони дадуть змогу підтримувати нормальне функціонування нирок протягом багатьох років.
Вагітність при АДПКН
Вагітність не протипоказана жінкам із АДПКН. Існує підвищений ризик розвитку високого кров’яного тиску під час вагітності, що призведе до додаткового навантаження на нирки. Отже, важливо впевнитись у тому, що лікарю відомо про Ваш стан. Більшість дітей з АДПКН почувають себе дуже добре. Кісти можна побачити у дуже ранньому віці, або навіть тоді, коли дитина ще знаходиться в утробі матері, але це не обов’язково може бути пов’язано з клінічними симптомами або порушенням ниркових функцій.
Діти
Зараз за допомогою ультразвукового сканування можливо побачити ниркові кісти у дітей із родин, де виявлявся АДПКН. У дітей АДПКН перебігає безсимптомно, у разі клінічних проявів найчастішими є підвищення артеріального тиску та запалення сечових шляхів.
Харчування та дієта при АДПКН
Нещодавні дослідження показують, що здоровий спосіб життя, збалансована дієта та регулярні вправи суттєво покращують прогноз захворювання.
Спеціальна дієта не розроблена. Основна функція нирок – виводити відходи з організму, а основним джерелом цих відходів є їжа, яку ми споживаємо, особливо протеїн. Коли особа втратила значний обсяг ниркових функцій, її лікарем може бути призначена дієта з низьким вмістом білка.
Уникайте великої кількості червоного м’яса, це може допомогти захистити нирки. Також добре включити до Вашої дієти і інші джерела білків, такі як курка, риба, бобові культури та макаронні вироби.
Слід уникати великої кількості солі. Це важливо, коли люди приймають певні препарати від кров’яного тиску та страждають від ниркової недостатності. Сольова дієта може призвести до небажаного підвищення тиску. Проблема з сіллю полягає в тому, що сіль є консервантом і міститься у всіх консервах та напівфабрикатах. Здоровою альтернативою є фрукти, салат, та більшість свіжих овочів.
Може допомогти споживання великої кількості води. Коли люди споживають багато рідини, нирки виробляють більше сечі. Це дозволяє тілу легше позбавлятись від відходів. Також важливо пити воду для уникнення зневоднення. При АДПКН може існувати проблема утримання нирками води. Отже, важливо брати з собою у довгу прогулянку чи на пікнік багато води та іншої рідини.
Пацієнтам із полікістозом нирок та печінки рекомендовано утримуватись від вживання напоїв, що містять кофеїн, тобто кави, чаю і певних охолоджувальних напоїв. Нещодавне лабораторне дослідження свідчить про імовірність того, що кофеїн може прискорити збільшення ниркових і печінкових кіст. Відомо, що кофеїн призводить до збільшення у ниркових клітинах рівня речовини під назвою циклічний аденімонофосфат, що прискорює збільшення кіст.
Вживання алкоголю у малих кількостях або вживання його час від часу не шкодить ниркам і печінці. Однак, вживання більше ніж 90 грамів алкоголю на день призводить до підвищення кров’яного тиску і шкодить печінці.
Таким чином, підсумовуючи вище викладене, сформулюємо деякі загальні поради:
- По-перше, Вам необхідно дізнатись якомога більше про АДПКН. Нова інформація з’являється постійно.
- Регулярно відвідуйте лікаря, та регулярно перевіряйте кров’яний тиск.
- Регулярно робіть вправи. Оберіть вид спорту, що не вимагає надмірних фізичних навантажень, оскільки сильний удар у спину може викликати набряк кіст та, як результат, появу крові у сечі. Оберіть таку діяльність, що Вам подобається і що є зручною для Вас. Не рекомендуються вправи з важкої атлетики, на відміну від плавання та аеробіки.
- Дотримуйтесь здорової дієти. Особливої дієти для людей з АДПКН немає, хоча деякі дослідження показують, що кофеїн може призвести до збільшення кіст. Немає достовірних свідчень про те, що нормальна/звичайна кількість білків/протеїнів є шкідливою. Однак, виявляється, що вживання великої кількості солі може спричинити підвищення тиску, отже, рекомендується дотримання дієти зі зниженим вмістом солі.
- Не вживайте алкоголь у великих кількостях. Хоча точних даних про вплив вживання алкоголю при АДПКН немає, зайвий алкоголь призводить до підвищення тиску.
- Якщо бажаєте отримати генетичну консультацію, запишіться на прийом до медичного генетика, зокрема, якщо Вас турбує можливість успадкування хвороби Вашими дітьми, чи є занепокоєння щодо планування сім’ї.
- Попросіть Вашого лікаря провести скринінг родини на АДПКН. УЗД доступне у найближчій місцевій лікарні.
- Уникайте всіх форм кофеїну – кави, чаю, коли, шоколаду та деяких видів аспірину (кофацил, аскофен). Читайте покази.
- Лікуйте всі запалення сечових шляхів та сечового міхура одразу. Зв’яжіться з Вашим лікарем.
- Не застосовуйте жодних лікарських препаратів, не порадившись з лікарем. Уникайте препаратів, що містять ібупрофен.
Дослідження
Лікування ускладень, контроль за кров’яним тиском, діаліз та трансплантація нирок є єдиними методами лікування АДПКН. За останні 20 років у всьому світі дослідженню цієї хвороби приділялось доволі багато уваги. Є надія, що будуть знайдені методи відстрочки початку розвитку кіст та/або погіршення функцій нирок. Як показують клінічні дослідження, контроль за тиском та інфекціями нирок, вживання меншої кількості м’яса та здоровий спосіб життя можуть допомогти зменшити ускладнення, а в деяких випадках уповільнити ріст кіст. Отже, окрім загальних порад, на даний момент специфічних дієт та препаратів немає.
Не так давно була визначена послідовність аномального гену на 16-ій хромосомі і є надія, що після ідентифікації генетичного продукту лікування стане можливим.
|
Полікістоз нирок: Виклик хворобі, що вразила сотні тисяч людей Джоел Р. Купер Кілька років тому я зустрічався з жінкою, батько якої, виконавчий директор великої комп’ютерної компанії, був хворий на полікістоз нирок. Він отримував лікування діалізом у домашніх умовах, певний час він почувався нормально, а потім в результаті ускладнень він помер. Пригадую, як одного дня я відвідав його і побачив, як машина забирала з його тіла кров, заганяла її в механічні нетрі, а потім якимось чином очищену кров повертала назад. Оскільки я ніколи не працював в медичному закладі, то бачити, як він лежить прикутий до машини, від якої залежало його життя, було для мене дуже незручно і неприємно. Можливо ця ситуація нагадала мені про хрупкість життя загалом і про мою власну смертність. Це було моє перше зіткнення із полікістозом нирок. І це мало на мене певний вплив. Незважаючи на серйозність ПКН, більшість пацієнтів з ПКН ведуть нормальне життя і не потребують змін у фізичній діяльності та способі життя, авжеж якщо їх звички не шкодять здоров’ю (паління, вживання надмірної кількості алкоголю, вживання наркотиків) або якщо симптоми не починають проявлятись. |
Питання, що найчастіше виникають щодо АДПКН
Питання:
У мене дуже великі нирки. Чи може це спричинити пошкодження інших органів? Чи можуть кісти поширитись і на інші органи?
Відповідь:
У деяких пацієнтів розмір нирок може бути достатньо великим, щоб викликати відчуття важкості по боках черевної порожнини, і деякі пацієнти власними руками можуть відчути нирки. Однак, самі нирки не можуть безпосередньо пошкодити інші органи, хоча кісти можуть виникати і в інших органах (наприклад, печінці), але вони не можуть прорости в органи, що розташовані поруч.
Питання:
Мені 47 років і в мене є кісти у нирках та печінці. Чи можливо їх видалення хірургічним шляхом без рецидиву?
Відповідь:
Видалення кіст не практикується, оскільки їх дуже багато і вони з’являються протягом усього життя. Деякі кісти також можуть бути занадто малими. Однак у випадках, коли кісти дуже великі та спричиняють біль чи повторні інфекції, можливе застосування дренування під УЗ-контролем. Такі великі кісти у нирках чи печінці іноді можуть бути “висмоктані”, щоб не допустити їх повторного наповнення. Раніше для лікування кіст застосовувались різноманітні хірургічні процедури, які тепер не застосовуються так широко.
Питання:
Мій син, якому 9 років, хворий на АДПКН. Чи повинен він відвідувати дитячого нефролога?
Відповідь:
Навряд чи у дитинстві у нього виникнуть якісь проблеми, пов’язані з АДПКН. Іноді у хворих дітей може підвищитись тиск або виникнути інфекція сечовидільних шляхів. Тому консультація нефролога бажана, також необхідно обговорити питання планування та подальшого нагляду у педіатра. Допомога генетика може знадобитися тоді, коли спадкова основа невідома, або картина чи розмір кіст є незвичайними.
Питання:
Моя мати та її брат були хворі на АДПКН, та в обох у 50 років був розрив аневризми Беррі. Мені 42. Чи слід мені обстежитись на предмет аневризм мозку?
Відповідь:
Деякі дослідження свідчать, що аневризми в родині передаються. У родинах, де є серйозні свідчення про попередній розрив аневризми, рекомендується спеціальне сканування мозку. Це називається магнітно-резонансна ангіографія. Це безболісна процедура, під час якої для обстеження судин у мозку застосовуються магнітні хвилі. У тих родинах, де траплялись розриви аневризм, ці сканування можна застосовувати неодноразово.
Питання:
У мене тиск 145/100 і мій лікар призначив мені препарат під назвою інгібітор аденілатциклази. Чи цей препарат зазвичай призначається пацієнтам з АДПКН, і чи може він мати якийсь шкідливий вплив на функціонування моїх нирок?
Відповідь:
Інгібітори аденілатциклази (АДЦ) є вдалим вибором для зниження тиску у пацієнтів з АДПКН. Однак більш важливим питанням, ніж вибір препарата, є адекватність контролю кров’яного тиску. Інгібітори АДЦ є сучасними препаратами, що мають мало побічних ефектів, найбільш поширеним серед яких є кашель. У деяких пацієнтів на початку прийому препарату, спостерігається невелике зниження ниркових функцій, але після припинення прийому все відновлюється. Значно рідше у деяких пацієнтів спостерігається сильне порушення ниркової функції внаслідок прийому інгібіторів АДЦ і тоді треба одразу припинити прийом. Таким чином, важливо через тиждень після початку прийому перевірити ниркову функцію. Жінкам слід уникати вагітності на час прийому цього препарату.
Питання:
Чи можна вжити якихось заходів, щоб затримати виникнення ускладнень АДПКН?
Відповідь:
Конкретних заходів щодо запобігання початку АДПКН немає. Однак, таким ускладненням, як високий тиск, можна запобігти, якщо дотримуватись дієти з низьким вмістом жирів та солі, регулярно робити вправи, підтримувати оптимальну вагу. Вам не можна палити. Вживання великої кількості рідини також може допомогти запобігти сечовій інфекції. Також не схвалюються важкі контактні види спорту, оскільки вони збільшують шанси набрякання нирок, та як наслідку, наявності крові у сечі.
Питання:
У мене АДПКН з відносно малою кількістю симптомів. Що мені слід питати під час моїх щорічних відвідувань нефролога, щоб відслідковувати свій стан з роками?
Відповідь:
Вам слід запитати, чи нормально функціонують ваші нирки, наскільки швидко погіршується їх стан. Вам також слід запитати, чи правильно контролюється ваш тиск. Оскільки нові дослідження АДПКН проводяться увесь час, також важливо питати про новітні досягнення.
Питання:
У мене з 20 років часто виникають сечові інфекції, а за останні 2 місяці було 3 випадки. Що я можу зробити задля їх запобігання?
Відповідь:
Якщо сечові інфекції регулярні та викликають ускладнення, необхідно здати аналіз сечі для визначення бактерій та приймати відповідні антибіотики. Вам слід вживати багато рідини, часто спорожнювати сечовий міхур, а особливо жінкам слід уникати довгого прийому ванн та джакузі. Надалі сечовим інфекціям також можна запобігати, приймаючи на ніч маленькі дози антибіотиків принаймні протягом 3 місяців. Часто після припинення прийому антибіотиків інфекції не повертаються.
Питання:
Якщо АДПКН є настільки поширеним спадковим захворюванням, то чому більшість людей про нього нічого не чули?
Відповідь:
Зараз загалом увага до генетичних захворювань зростає. Це має призвести до раннього діагностування та запобігання. У минулому багато випадків не було виявлено через відсутність раннього сканування, і ці випадки часто помилково діагностувались як гіпертонічна хвороба. Насправді, деякі особи з АДПКН живуть нормальним життям і не знають про свій діагноз.
Питання:
У батька моєї матері та 2 моїх двоюрідних братів/сестер виявлено АДПКН. Моя мати здорова і почуває себе добре, їй 49 років, але вона ніколи не перевірялась на АДПКН. Чи може АДПКН пропускати покоління? Оскільки мені тільки 26, чи слід мені попросити свого лікаря про скринінг? Я б хотіла знати, чи є в мене це захворювання.
Відповідь:
У цій ситуації мабуть краще спочатку зробити скринінг вашої матері. Якщо у неї до 49 років не розвинулись кісти, то навряд чи в неї вони розвинуться; таким чином вона буде вважатись здоровою. У цьому випадку вона не може передати АДПКН своїм дітям.
Питання:
Оскільки нещодавно була встановлена точна локація полікістозного гену, то чи буде можливим/доступним аналіз крові для діагнозу АДПКН?
Відповідь:
Точну структуру полікістозного гену виявилось важче визначити, ніж здавалося. Є надія, що нарешті з’явиться аналіз крові, за допомогою якого можна буде визначити наявність чи відсутність цього захворюваня на ранній стадії. Також є сподівання, що буде винайдене ефективне лікування чи ліки. На даний момент єдиним методом тестування є аналіз зчеплення. Для його проведення необхідні зразки крові двох хворих та двох здорових членів родини, а також УЗД.
Питання:
Мій батько потребував діалізу у 53 роки. Чи буде мені також потрібен діаліз?
Відповідь:
Немає свідчень про те, що ви потребуватимете діалізу тільки тому, що його потребував ваш батько. Ускладнення АДПКН, зокрема високий тиск, зараз лікуються краще, але все ж таки 50% пацієнтів до 59 років потребуватимуть діалізу. Можливо, якщо ви періодично вимірювали креатинін у крові, ви можете скласти графік, що показуватиме рівень змін ваших ниркових функцій.
Питання:
Чи може пацієнт з АДПКН отримати трансплантат?
Відповідь:
Трансплантація нирок – одна з можливостей, що може бути використана у тому випадку, коли нирки повністю припиняють функціонувати. Іншими можливостями є гемодіаліз та перитонеальний діаліз. Пацієнти з аутосомно-домінантнимі полікістозом нирок досить добре підходять для трансплантації, і почувають себе так само, як і інші пацієнти без полікістозу.
Питання:
Чи існують кілька типів полікістозу нирок?
Відповідь:
Так. Є більш рідкісна форма, що називається аутосомно-рецесивним полікістозом нирок (АРПКН), яка ще має назву дитячої, оскільки має надто важкий перебіг і пацієнти із цією формою помирають у ранньому дитячому віці. Це зовсім інше захворювання. Кісти також можуть бути спричинені і іншими менш поширеними генетичними синдромами. З віком у нирках також можуть формуватись ізольовані дегенеративні кісти. Вони, переважно, не викликають симптомів і потребують диференціації від АДПКН.
Питання:
Як я можу дізнатись чи хворі (чи відмовляють) мої нирки, якщо я не робив/робила жодних тестів?
Відповідь:
Ви не зможете про це дізнатись, поки функції не знизяться на 10%. Тому необхідні щорічні аналізи крові навіть у тих осіб, у яких нирки функціонують нормально. Аналізи крові вкажуть на порушення задовго до того, як стан нирок погіршиться настільки, що знадобиться діаліз. Пам’ятайте, що нирки раптово не відмовлять.
Питання:
Чи кількість сечі, що виводиться, якось вказує на те, як працюють мої нирки?
Відповідь:
Ні. У людей з хворими нирками спостерігається тенденція до виведення більшої кількості сечі, ніж звичайно, хоча вона може мати значно меншу концентрацію. Часто люди відчувають, що їм необхідно вставати вночі.
Адреси інформаційних сайтів, батьківських організацій та груп підтримки
Українські сайти:
- http://ukr.ibis-birthdefects.org/upolycys/ – Стаття про полікістоз нирок дорослого типу (інформація для спеціалістів).
- http://ukr.ibis-birthdefects.org/upolycy2/ – Інформація щодо полікістозу (інформація для батьків та пацієнтів).
- http://www.surgery.org.ua/ – Сайт Інституту хірургії та трансплантології Академії медичних наук України.
Російські сайти:
- http://www.ganimed.com.ua/encikl_yr_24.htm – Загальна інформація щодо полікістозу.
- http://www.med-lib.ru/bme/zab/des164.php – Загальна інформація щодо полікістозу.
- http://www.uroman.ru/page/kisty-pochek– Опис аномалій (кіст) нирок.
- http://www.nephro.ru/– Офіційний сайт Російського діалізного товариства.
- http://www.moscowdialysis.ru/ru/01_about_001.htm – Московський центр діалізу.
- http://transpl.ru/about_center/– Науково-дослідницький інститут трансплантології та штучних органів РФ.
Сайти англійською мовою:
- PKD Foundation for Research in Polycystic Kidney Disease (Фундація дослідження полікістозу нирок, США).
Фундація полікістозу нирок – єдина організація у світі, що займається тільки програмами підтримки досліджень і лікування полікістозу нирок. Вона створила мережу підрозділів, що зосереджуються на п’яти ключових питаннях: дарунок одним від інших (підрозділи, що допомагають пацієнтам та їх родинам тим, що вислуховують один одного, підбадьорюють та діляться інформацією); громадська увага (підрозділи, що пробуджують увагу громадськості до ПКН та поширюють інформацію про захворювання серед пацієнтів, громадськості, медичних працівників та засобів массової інформації); освіта (підрозділи, що проводять освітню роботу щодо полікістозу нирок шляхом створення освітніх форумів); збір коштів (підрозділи, що залучають осіб, корпорації та фундації, що зацікавлені у фінансовій підтримці досліджень ПКН, освіті та обізнаності); спонукання до дій (підрозділи, що допомагають лобіювати збільшення фінансування дослідженнь полікістозу нирок).
- National Kidney Foundation (Національна фундація ниркових хвороб, США).
- Nephkids Cyber Support Group (Інтерактивна група спілкування через електронну пошту батьків дітей із різними захворюваннями нирок).
- ADPKDchildren (Група спілкування батьків дітей з АДПКН).
- Euro PKD Friends (Друзі сімей з ПКН у Європі).
- American Association of Kidney Patients (AAKP) – Американська Асоціація нефрологічних пацієнтів (ААНП).
Асоціація має 13 відділів. Заснована у 1969 р. Це організація, що допомагає пацієнтам з хворими нирками та їх родинам подолати фізичний, емоційний та соціальний тягар ниркових захворювань. Мета – інформувати пацієнтів та їх родини для кращого розуміння їхнього стану, бути більш готовими до обставин та вести нормальне та активне життя. Забезпечує інформування та підтримку цих пацієнтів з хорими нирками, включаючи пацієнтів зі зниженою нирковою функцією, тих, що на діалізі та після трансплантації. Пропонує різноманітні освітні матеріали, журнали, що виходять кожних 2 місяці чи щоквартально, електронне листування та щорічну конвенцію.
Листування груп підтримки з ПКН
- AOL Chat Room – Для тих, у кого є доступ до America On Line (AOL), створено чат під назвою POLYCYSTS (чат дозволяє тим, хто зареєструвався, листуватись один з одним.). За цей чат відповідає Деб Кейс. Зв’язатись з нею можна за адресою: DCase0717@aol.com.
- Чат і Об’єднання MSN. Чат з понад 500 членами, також наявні інші ресурси. Зв’язатись з відповідальними за чат можна за адресою: tigresseye@hotmail.com.
- Дошка об’яв ARPKD. Дошка об’яв, що створена для тих, хто бажає поспілкуватись на теми, пов’язані з аутосомним рецесивним полікістозом нирок (дошка об’яв дозволяє користувачам спілкуватись у режимі он-лайн за допомогою повідомлень, подібних до електронної пошти). Дошка об’яв була створена Сюзанною ДіМарцо. За більш детальною інформацією можна звернутися за адресою: DiMarzo@erols.com.
- Transplant Email Discussion List. В цій поштовій службі ведеться дискусія на теми трансплантації органів. Дла того, щоб підписатися, необхідно надіслати повідомлення на адресу listserv@wuvmd.wustl.edu, в тексті якого написати: SUBSCRIBE TRNSPLNT Ваше Ім’я (тобто також вказати Ваше справжне імя).
- Bridget’s Polycystic Kidney disease chat & community: MSN Групи – чат та інші ресурси.
- RenalWeb – Vortex Web Site of the Dialysis World.
- Living Donors – Для тих, хто є донором.
Освітні та інформаційні сайти
- http://www.kidneyschool.org – Інформаційний сайт.
- http://nephron.com – Опис роботи нирок.
- http://www.rsnhope.org/kidney-disease-health-library/ – Багато тем, присвячених ниркам.
- http://www.hdcn.com/ – Журнал полікістозу нирок.
- http://www.aakp.org/ – Американська асоціація організацій пацієнтів, що страждають на ниркові захворювання.
- http://www.kidneyoptions.com/ – Сайт, присвячений проблемам хвороб нирок.
- http://www.jasn.org/ – Журнал Американського товариства нефрології.
- https://www.niddk.nih.gov/health-information/kidney-disease – Словник ниркових захворювань.
- https://familydoctor.org/condition/polycystic-kidney-disease/ – Інформаційний бюлетень про ПКН.
- https://www.mayoclinic.org/diseases-conditions/polycystic-kidney-disease/symptoms-causes/syc-20352820 – Короткий огляд інформації щодо ПКН.
Переглянуто редакційною колегією I.B.I.S.: 15/02/2002
Спінальна м’язова атрофія
(Spinal Muscular Atrophy)
Наталія Олексіївна Афанасьєва
Завідувачка Кримською медико-генетичною консультацією
м. Сімферополь
Синоніми:
Спінальна аміотрофія, хвороба Вердніга-Гоффмана, хвороба Кугельберга-Веландера, аміотрофія 5q.
Спінальна м’язова атрофія (СМА) – важке моногенне нервово-м’язове захворювання, в основі якого лежать прогресуючі дегенеративні зміни мотонейронів спинного мозку.
Історична довідка:
Захворювання описане G. Werdnig в 1891 р. і J. Hoffmann у 1891 р. У 1956 р. Kugelberg і Welander була описана спінальна аміотрофія, яка відрізнялася від форми Вердніга-Гоффмана пізнішим віком манiфестації захворювання. Fried і Emery у 1971 р. припустили існування форми СМА, проміжної за ступенем важкості між хворобами Вердніга-Гоффмана і Кугельберга-Веландера. У 1990 р. різні автори на основі аналізу зчеплення з поліморфними ДНК-маркерами незалежно повідомили дані про картування усіх трьох форм СМА у хромосомному регіоні 5q. Таким чином, утвердилось уявлення про різні форми СМА, як про єдине захворювання.
Клініка:
У 1994 р. Міжнародний консорціум з СМА затвердив класифікацію цього захворювання. Клінічні форми визначались на основі критеріїв порушень функцій руху та часу маніфестації захворювання:
СМА, тип І – важкий – маніфестація захворювання до 6 місяців життя; пацієнти ніколи не сиділи. Вроджена форма діагностується у перші дні і тижні життя. У деяких випадках жінки до кінця вагітності відзначають ослаблені рухи плоду. У хворої дитини відзначається різка гіпотонія м’язів із незначним тремором пальців рук і фібриляціями язика, арефлексія, часті наявні бульбарні розлади. Смерть, як правило, настає до двох років від інтеркурентної інфекції.
СМА, тип ІІ – проміжний – дебют хвороби до 18 місяців. Перші місяці життя дитина розвивається задовільно. Пацієнти здатні сидіти, але не можуть стояти та ходити. Поступово настає регрес рухових навичок, згасають сухожилкові рефлекси, з’являються м’язові атрофії, незначний тремор рук, фібриляція язика, тонус м’язів різко знижується. Психічний розвиток, зазвичай, відповідає нормі. Смертельний кінець – старше двох років.
СМА, тип ІІІ – м’який – маніфестація захворювання настає після 18 місяців. Перші місяці життя дитина розвиваться задовільно. Пізня форма виникає, коли діти вже добре опанували вікові рухові навички. Поступово розвивається м’язова слабість у проксимальних, а потім у дистальних відділах кінцівок, наростають м’язові атрофії, пригнічуються сухожилкові рефлекси. Характерні “качина” хода, гіперлордоз поперекового відділу хребта, формування контрактур суглобів. Здатність ходити при цій формі захворювання зберігається до 8-10 років і старше. Пацієнти доживають до дорослого віку.
Крім того, К. Zerres у 1995 р. запропонував розбити СМА ІІІ на дві підгрупи: А – з маніфестацією захворювання до трьох років, і В – з початком захворювання від трьох до тридцяти років; а також створити в класифікації новий тип СМА – СМА ІV – для хворих з маніфестацією хвороби старше 30 років.
Етіологія: моногенне аутосомно-рецесивне захворювання.
Співвідношення статей: Ч1 : Ж1.
Розповсюдженість:
СМА І-ІІІ зустрічається у різних регіонах світу, у популяціях з різною генетичною структурою. Середня поширеність усіх форм СМА складає 1:10000-20000 дітей або 1,2 на 100 тисяч населення. Виключення складають регіони, у яких описано виражене накопичення СМА. До них відносяться популяції з високими показниками інбридінгу: Бенгазі, Лівія, караїми в Ізраїлі, араби в Кувейті і популяції, в яких підвищення частоти СМА зумовлено ефектом родоначальника: у Канаді і на о. Реюньйон, де від однієї пари європейців походять 13 сімей з 38 хворими хворобою Вердніга – Гоффмана.
В Україні розповсюдженність СМА вивчалася у дитячій популяції Донецької області і в Автономній республіці Крим. В Донецькій області частота хвороби Вердніга-Гоффмана визначена як 2,64 на 100 тисяч дитячого населення, а хвороби Кугельберга-Веландера – 0,45 на 100 тисяч дитячого населення. У Криму частота усіх типів СМА складала (7,26±1,42) x 10-5, розповсюдженість – 1:13765, співвідношення типів СМА І:ІІ:ІІІ – 1:1,75:1,25.
Патогенез:
Зміни картовані у хромосомній області 5q11.2-q13.3. Делеції 7-го та 8-го екзонів гену SMN (від англ. “survival motor neuron gene”) були виявлені у хворих СМА з частотою 80-98% у залежності від типу СМА чи етнічної належності. У 27-37% хворих СМА виявлені гомозиготні делеції 5-го і 6-го екзонів гену NAIP (від англ. “neuronal apoptosis inhibitory protein gene”).
При патоморфологічному дослідженні при усіх формах СМА виявляється зменшення числа рухових клітин передніх рогів спинного мозку, причому переважно уражаються великі моторні клітини. Аналогічні зміни спостерігаються у рухових ядрах черепно-мозкових нервів. В окремих випадках знаходять дегенеративні зміни в мозочку, зорових горбах, задніх стовпах спинного мозку; передні корінці потоншені. Периферичні нервові волокна також змінені, особливо їх кінцеві структури.
Лікування: радикального методу не існує, використовується симптоматична терапія.
Профілактика:
Медико-генетичне консультування, молекулярно-генетичне обстеження родини з наступною пренатальною діагностикою генотипу плоду.
Номер з каталогу МІМ:
253400 Spinal Muscular Atrophy III; SMA3
Література:
- Zerres K, Rudnik-Schoneborn S. Natural history in proximal spinal muscular atrophy. Clinical analysis of 445 patients and suggestions for a modification of existing classifications. Arch Neurol. 1995 May;52(5):518-23.
- Radhakrishnan K, Thacker AK, Maloo JC, Gerryo SE, Mousa ME. Descriptive epidemiology of some rare neurological diseases in Benghazi, Libya. Neuroepidemiology. 1988;7(3):159-64.
- Fried K, Mundel G. High incidence of spinal muscular atrophy type I (Werdnig-Hoffmann disease) in the Karaite community in Israel. Clin Genet. 1977 Oct;12(4):250-1.
- Teebi AS. Autosomal recessive disorders among Arabs: an overview from Kuwait. J Med Genet. 1994 Mar;31(3):224-33.
- Pascalet-Guidon MJ, Bois E, Feingold J, Mattei JF, Combes JC, Hamon C. Cluster of acute infantile spinal muscular atrophy (Werdnig-Hoffmann disease) in a limited area of Reunion Island. Clin Genet. 1984 Jul;26(1):39-42.
- Садеков И. А., Евтушенко С. К. Наследственные заболевания и пороки развития нервной системы у детей (клинико-эпидемиологическое исследование) //Журн. невропатологии и психиатрии. – 1989. – № 8. – C. 45 – 48.
- Афанасьева Н.А. Распространенность наследственных нервно-мышечных заболеваний среди детского населения Автономной республики Крым //Материалы научно-практической конференции “Сучасний стан медичної генетики в Україні”. – Киев, 1999. – С.12.
- Lefebvre S, Burglen L, Reboullet S, Clermont O, Burlet P, Viollet L, Benichou B, Cruaud C, Millasseau P, Zeviani M, et al. Identification and characterization of a spinal muscular atrophy-determining gene. Cell. 1995 Jan 13;80(1):155-65.
- Bussaglia E, Clermont O, Tizzano E, Lefebvre S, Burglen L, Cruaud C, Urtizberea JA, Colomer J, Munnich A, Baiget M, et al. A frame-shift deletion in the survival motor neuron gene in Spanish spinal muscular atrophy patients. Nat Genet. 1995 Nov;11(3):335-7.
Переглянуто редакційною колегією I.B.I.S.: 8/05/2003
Дивіться також:
Атрезія хоан
(Choanal Atresia)
Наталія Ігорівна Юськів
Лікар-генетик
Волинського обласного дитячого територіального медичного об’єднання
Основні діагностичні критерії:
Атрезія хоан – це однобічна або двобічна обструкція задніх відділів носових ходів. Характеризується широкими клінічними проявами, від ціанозу та респіраторного дистресу до порушення евакуації назального секрету. Атрезія хоан, якщо вона повна і двобічна, є однією з причин дихальних розладів, що виникають відразу після народження. Це пов’язано з відсутністю носового дихання у новонароджених. Однобічна атрезія рідше стає причиною респіраторного дистресу; симптомом однобічної хоанальної атрезії зазвичай буває порушення евакуації мукоїдного секрету. Атрезія хоан буває проста мембранозна, мембранозно-кісткова та кісткова; однобічна та двобічна; повна та неповна.
Патогенез:
Найбільш прийнятною у виникненні атрезії хоан вважається теорія персистування назобуккальної мембрани, яка в ранньому ембріональному періоді відокремлює носові ямки від примітивного рота. В нормі ця мембрана редукується на 6-му тижні ембріонального розвитку, але якщо це з якихось причин не відбулося, то клітини тканин мезодерми мігрують між шарами епітелію, внаслідок чого виникає мембранозна або кісткова перетинка між порожниною носа та носоглоткою.
Діагноз:
Встановлюється на основі неможливості проведення катетера в носоглотку через один чи обидва носових ходи. Якщо катетер чи зонд не проникає більше ніж на 32 мм, можна запідозрити атрезію хоан. Для підтвердження діагнозу використовується комп’ютерна томографія.
Частота виникнення:
Приблизно 1 на 7000 новонароджених.
Співвідношення між статтю:
Чоловіки:жінки – 1:2 при однобічній атрезії; при двобічній – 2:1. Правобічна атрезія хоан виникає частіше.
У 90% всіх випадків зустрічається кісткова атрезія, лише у 10% – мембранозна. У 50% атрезія хоан поєднується з іншими аномаліями та входить до складу CHARGE-асоціації (таб. 1). Стеноз хоан також може зустрічатися при деяких станах, наприклад, при гіперостотичних скелетних дисплазіях та черепних аномаліях. Більшість випадків атрезії хоан – спорадичні, але тенденція до успадкування цієї аномалії була простежена в деяких сім’ях, особливо при однобічних ураженнях. Так, Lang ще в 1912 році описав випадок атрезії хоан у жінки та двох її дітей (дочки та сина). Stewart в 1931 p. повідомив про двох сестер з такою аномалією. Атрезію хоан при трисомії 13-15 описав Dickson у сестер-близнюків.
Таблиця 1*.
Поєднання атрезії хоан з іншими аномаліями
| Синдром | Симптоми | Тип успадкування. Етіологія |
|---|---|---|
|
Антле-Бікслера |
Краніосиностоз, променево – плечовий дизостоз, виступаючі лобні горби, варусні деформації стегна, контрактури суглобів |
Аутосомно-рецесивний |
|
Бамфорта |
Розщелина надгортанника чи піднебіння, гіпотиреоз, pili torti |
Невідомо |
|
Брахама |
Гіперостотична дисплазія, кортикальний гіперостоз, симфалангізм, гіпоплазія дентину, прогерія |
Невідомо |
|
CHARGE-асоціація |
Колобоми, вроджені вади серця, атрезія хоан, затримка зросту та розвитку, іноді гіпоплазія геніталій, аномалії вух та глухота |
Спорадичні випадки |
|
Крузона |
Краніосиностоз, проптоз, гіпоплазія середньої частини обличчя, “дзьобоподібний ніс” |
Аутосомно-домінантний |
|
Виступаюче чоло, затримка зросту та розвитку, диспропорційно прискорений кістковий вік, рання смертність |
Невідомо |
|
|
Пфайфера |
Краніосиностоз, широкі І-ші пальці кистей та ступнів |
Аутосомно-домінантний |
|
Шинцеля-Гідеона |
“Запала” середня частина обличчя, затримка зросту та розвитку, Вормієві кістки |
Аутосомно-рецесивний |
|
Колобоми повік, опущені кути ока, гіпоплазія вилиць, аномалії вух, глухота |
Аутосомно-домінантний |
* Не включені випадки описані Flannery (ротоглоткові скелетні аномалії, атрезії), Salinas et al. (краніосиностоз, колобоми повік, розщелина нижньої губи), Семанова та ін. (мікроцефалія – імунодефіцит), Kaplan et al. (акро – краніо – фаціальний дизостоз), Hurst et al. (вади серця, низький зріст, атрезія хоан), Greenberg (атрезія хоан, ателія), Goldblatt and Viljoen (дефект променевої кістки, атрезія хоан), Edwards et al. (мікрофтальмія – мікроцефалія – мозкові аномалії).
Двобічна повна атрезія хоан представляє невідкладну ситуацію для новонароджених, які дихають тільки через ніс і мають диспное та ціаноз внаслідок повної обструкції задніх носових отворів. Клінічна картина нагадує асфіксію новонароджених. Проста симуляція крику приводить до того, що дитина починає дихати ротом і дихальні розлади тимчасово зникають. До виконання хірургічної корекції вади прохідність дихальних шляхів можна підтримувати за допомогою повітроводу. Дихальні розлади часто супроводжуються різко вираженою тахікардією, що деколи призводить до постановки діагнозу “вроджена вада серця“. Повна атрезія хоан, якщо вона вчасно не діагностована, може стати причиною смерті новонародженої дитини. Описані випадки діагностики двобічної атрезії хоан в старшому віці. Такі діти мали аносмію, відставали у вазі, були бліді та апатичні, мали порушений сон через відсутність носового дихання.
Однобічна атрезія хоан частіше “пропускається” у періоді новонародженості. Хірургічна корекція цієї вади може проводитися в будь-який період дитинства. При двобічній атрезії хоан необхідно негайно відновити прохідність верхніх дихальних шляхів. Іноді необхідна трахеотомія. Дихання через рот з’являється у дитини на 4 – 6 тиждень життя. Прогноз для життя сприятливий, якщо атрезія хоан є ізольованою вадою розвитку і не є складовою CHARGE-асоціації.
Номер з каталогу МІМ:
214800 CHARGE Syndrome
603457 Arhinia, Choanal Atresia, and Microphthalmia
179270 Radial Ray Hypoplasia with Choanal Atresia
Література:
- Hardcastle B. Nose, Posterior Atresia. In: Buyse ML, ed. Birth Defects Encyclopedia. Dover: Center for Birth Defects Information Services, Inc., 1990:1265-1266.
- McKusick VA. Choanal Atresia, Posterior. OMIM, 214800.
- Myer CM. Nose, Anterior Atresia. In: Buyse ML, ed. Birth Defects Encyclopedia. Dover: Center for Birth Defects Information Services, Inc., 1990:1259-1260.
- Qazi QH. Nose, Choanal Atresia-Lymphedema. In: Buyse ML, ed. Birth Defects Encyclopedia. Dover: Center for Birth Defects Information Services, Inc., 1990:1261-1262.
- Stevenson RE, Hall JG, Goodman RM. Human Malformations and Related Anomalies. In 2 vol. New York, Oxford: Oxford University Press, 1993. Vol.2: 327-328.
- Warkany J. Choanal Atresia. In: Congenital Malformations: Notes and Comments. Chicago: Yearbook Medical Publishers, Inc., 1971:594-595.
Переглянуто редакційною колегією I.B.I.S.: 15/02/2002
Атрезія жовчних шляхів
(Biliary Atresia)
Г.Л. Лінчевський
Доцент, зав. курсом неонатології,
Донецький державний медичний університет ім. М. Горького
В.В. Татарченко
Курс неонатології факультету післядипломної освіти,
Донецький державний медичний університет ім. М. Горького
Аномалії жовчовивідних шляхів – імовірно, найбільш частий анатомічний дефект у людини. Безсумнівно, частина цих аномалій є малими морфогенетичними варіантами. Аномалії жовчного міхура і жовчних шляхів класифікують таким чином [Писарєв А. Г., Обольская Н. М., 1993]:
- Аномалії положення жовчного міхура.
- Гіпоплазія жовчного міхура.
- Агенезія жовчного міхура.
- Додатковий жовчний міхур.
- Деформації жовчного міхура.
- Аномалії жовчної протоки.
Відповідно до Міжнародної статистичної класифікації хвороб 10-го перегляду, атрезія, вроджений стеноз і киста загальної жовчної протоки входять у групу вроджених вад жовчної протоки.
Визначення:
Атрезія жовчних шляхів – одна з вроджених аномалій жовчних ходів, що зустрічається з частотою 1 випадок на 20000-30000 немовлят.
Атрезія жовчних шляхів (особливо внутрішньопечінкових) у більшості випадків пов’язана з:
- Перенесеним внутрішньоутробно гепатитом, частіше викликаним одним із реовірусів.
- Несприятливими факторами, що діяли на 4-8 тижні внутрішньоутробного життя. Зазвичай, це поєднується з іншими ВВР (нирок, серця, хребта, поліспленією).
- Трисоміями по 13 та 18 парах аутосом.
Виділяють атрезії позапечінкових жовчних шляхів (без чи у поєднанні з атрезією жовчного міхура), атрезії внутрішньопечіночних жовчних проток (без чи у поєднанні з атрезіями позапечінкових жовчних шляхів), тотальні.
Клінічна картина:
Клініка атрезії жовчних шляхів характеризується жовтяницею, що дебютує з перших днів життя, або протягом перших 2-3 тижнів життя, має прогресуючий характер, зумовлена високими рівнями прямого білірубіну. Випорожнення ахолічні, хоча у перші дні життя можуть бути нормального забарвлення. Стеркобіліну в випорожненнях немає. Сеча інтенсивно забарвлена. Печінка збільшується та стає щільною. До 2 місяців життя істотно збільшується і селезінка, з’являється портальна гіпертензія з асцитом, погіршується загальний стан. У перший місяць життя загальний стан може бути непорушеним, і дитина навіть може набирати масу тіла, непогано ссати. Вже через тиждень після появи знебарвлених випорожнень може розвинутись вітамін D-дефіцитний геморагічниий синдром, а після появи портальної гіпертензії – кривава блювота. До 5-6 місяців життя (без хірургічної допомоги) розвиваються біліарний цироз печінки, периферична нейропатія. Атрезія внутрішньопечінкових жовчних проток часто поєднується з іншими аномаліями: обличчя, серця, хребта, судинного русла печінки. Крім жовтяниці та ахолії випорожнень можуть бути ксантоми на шкірі, свербіж, стеаторея, геморагічний синдром, нервово-м’язові розлади (втрата сухожилкових рефлексів, ознаки порушення черепно-мозкової інервації, парези нижніх кінцівок – наслідок дефіциту вітаміну Е).
При біохімічних дослідженнях виявляють у сироватці крові низький рівень факторів протромбінового комплексу, гіпопротеїнемію, гіпоальбумінемію та високі рівні прямого білірубіну, активності лужної фосфатази, лейцинамінопептидази, 5-нуклеотидази.
Діагноз:
Діагноз вимагає обов’язкових додаткових досліджень: ультразвукове дослідження печінки, операційна холангіографія та ін., тому що перебіг неонатального гепатиту характеризується холестазом і знебарвленими випорожненнями. Диференційний діагноз проводять також із синдромом згущення жовчі, лікарськими ураженнями печінки (парентеральна гіпераліментація, саліцилати, ацетоміфен, ріфампіцин та ін.), спадковими порушеннями обміну (жовтяниці Криглера-Найяра, Ротора, Дабина-Джонса, галактоземія, тирозиноз, дефіцит альфа-1-антитрипсину), гіпотиреозом.
Діагноз атрезії жовчних ходів необхідно поставити немовлям якомога раніше, тому що успіх операції пов’язаний з віком, у якому проводиться операція, крайній термін – перші два місяці життя. Тому немовлята з постійним холестазом повинні розглядатися як екстренні хворі, що мають потребу в негайній діагностиці і лікуванні їх в умовах спеціалізованого дитячого хірургічного відділення.
Сьогодні первинним скринінг-методом у діагностиці уражень жовчовивідної системи є УЗД печінки і жовчних шляхів, з якого варто починати обстеження дитини при підозрі на патологію жовчовивідної системи.
Спеціальні обстеження:
Методика УЗ дослідження – поліпозиційна із застосуванням методів дозованої компресії для кращої візуалізації. При проведенні УЗ дослідження варто дотримуватись наступних методичних прийомів:
- детальне ультразвукове дослідження печінки з виміром розмірів, характеристики контурів, ехогенності, структури;
- прицільний огляд жовчного міхура з виміром його розмірів;
- детальний огляд внутрішньо- та позапечінкових жовчних протоків, вимірювання діаметру загальної жовчної протоки, лівої печінкової протоки;
- динамічне ультразвукове дослідження, частота якого визначається рівнем білірубінемії.
Ультраехографія – проста й атравматична процедура, що використовується в усіх випадках у хворих з холестазом, на першому рівні дослідження цих пацієнтів.
УЗД ознаки атрезії: відсутній чи маленький жовчний міхур (трикутний тяж), що не змінює розміри при прийомі їжі, і збільшена ехогенність печінки (мал. 1). Скорочення жовчного міхура після годування виключає атрезію жовчних проток.
Мал. 1. Ехограма. Атрезія внутрішньо-
та позапечінкових жовчних шляхів
На підставі вищезазначеного запропоновано новий метод розпізнавання і лікування вродженої патології жовчовивідної системи, що включає в себе комбіноване застосування лапароскопії, черезшкірної черезпечінкової холецистохолангіографії з рентгенологічним контролем (під контролем електронно-оптичного перетворювача) у режимі реального часу (мал. 2,3).
Мал. 2. Ехограма. Транскутанна
черезпечінкова холецистохолангіографія
під контролем лапароскопа
(контрастна речовина в 12-палу
кишку не проходить)
Мал. 3. Ехограма. Транскутанна
черезпечінкова холецистохолангіографія
під контролем лапароскопа
(контрастна речовина в
12-палій кишці)
Метод полягає в наступному: під контролем введеного через пупок лапароскопа робимо через окремий прокол у правій підреберній області транскутанну черезпечінкову холецистохолангіографію шляхом введення водорозчинної контрастної речовини. Отриману рентгенологічну картину спостерігаємо в динаміці в режимі реального часу на екрані монітору електронно-оптичного перетворювача.
До позитивних сторін даного методу відноситься:
- можливість застосування в новонароджених дітей;
- природне (антеградне) введення контрастної речовини не допускає розвитку висхідного холангіту;
- мінімальна травматичність;
- висока інформативність;
- можливість у деяких випадках усувати перешкоду в ділянці жовчної протоки.
Лікування:
При встановленому діагнозі – оперативне: або холедохоеюностомія, або протоентеростомія (операція Касаї – створення прямого анастомозу між декапсульованою розкритою поверхнею печінки в ділянці воріт і кишечником), або пересадка частини печінки. Без хірургічного лікування діти гинуть на 2-3-у році життя. Чим раніше буде проведена операція, тим кращий прогноз. У випадках пересадки печінки 25-50% рано оперованих дітей переживають 5 і більше років. Результат залежить від наявності чи відсутності запального та склеротичного процесу в печінці. До операції лікування підтримуюче. Глюкокортикоїди неефективні, так само як і інші медикаментозні засоби. Водночас необхідно раз у тиждень вводити вітамін Д парентерально, періодично проводити курси вітамінів Е, D.
Номер з каталогу МІМ:
210500 Biliary Atresia, Extrahepatic; EHBA
Література:
- Акопян В.Г. Хирургическая гепатология детского возраста.- М.: Медицина, 1982.- 432 с.
- Ашкрафт К.У., Холдер Т.М. Детская хирургия: В 2 томах.- С-Пб, 1997.- Т.2.- С. 161-169, 190-210.
- Дегтярев Ю. Г. Лучевая диагностика врожденных аномалий желчных протоков //Новости лучевой диагностики.- 2001.- № 1-2.- С.56-59.
- Kalicinski P, Kaminski A, Pavlowska J et al. Liver transplantation in children – the Children’s Memorial Health Institute experience. Surgery Childhood Intern 2000;8(3):135-140.
- Kasai M, Kimura S, Assakura Y. Surgical treatment of biliary atresia. J. Pediatr. Surg 1968;73(6):665-671.
- Lilly JR, Karrer FM, Hall RJ et al. The surgery of biliary atresia Ann. Surg 1989;210(3):289-296.
Переглянуто редакційною колегією I.B.I.S.: 13/02/2004
Дивіться також:
Атрезія жовчних шляхів
(Biliary Atresia)
О.А. Мельничук
Зав. відділенням патології новонароджених
Волинського обласного дитячого територіального медичного об’єднання
Т.Д. Загорулько
Лікар-неонатолог відділення недоношених дітей
Волинського обласного дитячого територіального медичного об’єднання
Визначення:
Відсутність позапечінкових чи внутрішньопечінкових жовчних протоків, а також можлива тотальна їх відсутність.
Частота:
Частота деструкції жовчних шляхів становить 1 : 10000-20000 новонароджених.
Етіологія:
За даними Б.Х. Лендіга (1974) вважають, що більша частина випадків атрезії жовчних шляхів є наслідком перенесеного гепатиту (інфекційний гепатит А, В, С, Д, Е), цитомегалії, герпесу, краснухи, ентеровірусів, реовірусів ІІ типу, лістерії. В деяких випадках виникнення вади розвитку жовчних шляхів зумовленно дією неблагоприємних неінфекційних факторів на зачаток печінки на 4-8 тижні внутрішньоутробного життя. Часто у таких дітей наявні вади розвитку інших органів (частіше нирок, серця, хребта, шлунково-кишкового тракту).
Лістеріозна та реовірусна інфекція може спостерігатися в послідовних вагітностях, що зумовлює сімейні випадки біліарних атрезій (Bercoft 1972, Cunningham та Sybert 1988).
Основні діагностичні критерії:
Кожна дитина при наявності холестазу в перші 3 місяці життя повинна бути обстежена на біліарну атрезію.
Клініка:
Першою ознакою атрезії жовчних шляхів є жовтяниця, часто її розцінюють як фізіологічну. У деяких хворих виражена жовтяниця виникає на 2-3 тижні життя. Характерним для холестазу є зеленкуватий відтінок шкіри через накопичування в крові білівердину.
Другою ознакою холестазу є постійно або періодично знебарвлені випорожнення. В перші дні життя або 1-2 тижні випорожнення можуть бути нормальними. Стеркобілін в калі відсутній. Сеча інтенсивно забарвлена, але уробіліну в ній немає.
Печінка збільшується і стає щільною, також збільшується селезінка, виникає розширення вен передньої черевної стінки (спочатку в верхній частині), пізніше виникають інші ознаки портальної гіпертензії.
Вже через тиждень після знебарвлених випорожнень може виникнути геморагічний синдром внаслідок дефіциту вітамін-К-залежних факторів зсідання крові.
Якщо на 1-му місяці життя дитина не виглядає дуже хворою, то на другому місяці вона стає малоактивною, погано набирає вагу.
Поступово виникають ознаки дефіциту жиророзчинних вітамінів А, Е, Д, нервово – м’язові розлади, ксантоми на шкірі, а з 4-5 місяців сверблячка.
В копроцитограммі типова стеаторея. Для клінічного аналізу крові характерно наростання анемії і лейкопенії, може бути і тромбоцитопенія.
При біохімічному аналізі рівень прямого білірубіну в сироватці крові приблизно 6-10 mg%, низький рівень факторів протромбінового комплексу, гіперпротеінемія, гіпоальбумінемія, високий рівень лужної фосфатази, гіперхолестеринемія буває незавжди.
Екстрапечінковий холестаз характеризується тим, що діти народжуються з нормальною масою тіла, рано з’являються знебарвлені випорожнення, печінка щільна, нерівна.
При внутрішньопечінковій атрезії жовтяниця виникає в ті терміни, що і при позапечінковій, але знебарвлені випорожнення частіше розпочинаються не з перших днів життя. Досить повільно збільшуються розміри печінки, погіршення стану настає пізніше.
Саме для внутрішньопечінкових атрезій характерний розвиток ксантом на другому році життя.
Отже, диференційний діагноз можливий тільки після проведення додаткового обстеження: ультразвукового обстеження печінки, оперативної холангіографії, біопсії печінки, тощо.
Ускладнення:
Розвиток біліарного цирозу, недостатня кількість жиророзчинних вітамінів, порушення всмоктування жирів.
Співвідношення статі: Ч1 : Ж1-2.
Вік маніфестації: відразу після народження.
Генне картування і групи зчеплення генів: невідомі.
Лікування:
При відсутності лікування основна маса дітей гине до двох років, але протягом останніх 20 років завдяки проведенню операції портоентеростомії (по Каsаі) можливе довготривале виживання цих дітей.
Ще більшого успіху було досягнуто при пересадці печінки у випадках відсутності ефекту від операції портоентеростомії.
Операцію портоентеростомії розробив в 1959 році Kasai (Японія). Вона дозволяє досягти відтоку жовчі, що значно покращує прогноз. Ця операційна техніка застосовується в усьому світі; існують дані про віддалені наслідки такої операції (Houwen 1989, Ohi 1990, Karrer 1990, Laurent 1990, Miyano 1993). Ці дослідження показують, що довготривалий прогноз достатньо сприятливий у тих дітей, які через рік після операції знаходяться в задовільному клінічному стані. Практично всі автори підкеслюють важливість ранньої операції. Найкращі результати досягаються, якщо операцію проводять до 8-ми тижнів життя, 70% дітей виживали протягом 10-ти років. В групі дітей прооперованих в віці більше 60 днів, 10-ти річного віку досягли 27%; в віці після 90 днів – лише 11%. Не було повідомлень про успішну операцію після 140-го дня життя, тому в цьому віці повинна розглядатись можливість первинної пересадки печінки.
Серед дітей, тривалість виживання яких становила більше 10 років, у 66% стан здоров’я був задовільним, жовтяниці не відмічалось; у 18% відмічалась портальна гіпертензія; у 16% – функція печінки була значно порушена.
В більшості випадків виконують радикальне висічення всієї залишкової тканини жовчних протоків, включаючи жовчний міхур. Проксимальні жовчні протоки, які розташовані над венами, зрізають до рівня печінки. Мета такого радикального висічення – відкриття дрібних печінкових протоків, які виходять з печінки та розповсюджуються на глибину до 1 мм в фіброзну тканину під капсулою печінки. Операція закінчується накладенням анастомозу звичайної петлі тонкої кишки по Ру з межами висіченої фіброзної тканини.
Бактеріальний холангіт, який характеризується гіпертермією, та підвищенням вмісту сироваткового білірубіну, спостерігається в 40% дітей після портоентеростомії. Лікування включає призначення антибіотиків широкого спектру дії з наступною корекцією лікування за результатами посіву крові.
Портальна гіпертензія внаслідок фіброзу або цирозу печінки спостерігається у 60% дітей через 2-2,5 роки після портоентеростомії.
Без лікування лише 5% дітей доживають до 2 років.
Атрезія жовчних шляхів є найбільш частим показом до пересадки печінки у дітей.
Розробка методів пересадки сегментів органів дозволяє проводити цю операцію в дуже ранньому віці. Можливість пересадки сегмента печінки від родичів робить операцію досить доступною. Показами до пересадки печінки є: повна невдача при проведенні портоентеростомії, печінкова недостатність, недостатній відток жовчі, неконтрольована портальна гіпертензія та рецидивуючий холангіт. В даний час 3-х річне виживання хворих після пересадки печінки становить біля 75%. В сучасних умовах портоентеростомія та пересадка печінки розглядаються як взаємодоповнюючі процедури при атрезії жовчних шляхів.
Диференціальна діагностика:
В плані диференціальної діагностики з атрезією жовчних шляхів мають значення синдроми спадкової гіпоплазії жовчних ходів.
При синдромі канальцевої гіпоплазії жовчних шляхів з аутосомно-рецесивним типом успадкування, описаному Д. Аланжилем, наявні інші вади розвитку: гіпоплазія або стеноз легеневої артерії, вади хребта, нирок, тощо. Характерне обличчя з високим, дещо виступаючим лобом, глибокорозташованими очними яблуками, гіпертелоризмом, прямим носом, маленьким підборіддям з ямкою або неглибоким роздвоєнням. Типово виражена гіперхолестеринемія, гепатомегалія, спленомегалія, іноді ксантоми. В подальшому діти відстають у фізичному, психомоторному та статевому розвитку.
Існують спадкові форми холестазу у дітей перших місяців життя:
- Синдром Ман-Альфрейа, коли ахолічні випорожнення тримаються до 3-5 місяців, а потім на протязі життя ніяких відхилень від норми немає.
- Синдром Байлера, коли після епізоду холестазу в перші місяці життя в подальшому формується біліарний цироз печінки.
Дієта:
При холестазі довголанцюгові тригліцеріди засвоюються дуже погано, тоді як середньоланцюгові тригліцеріди – краще. Тому рекомендуються суміші збагачені середньоланцюговими та ненасиченими жирними кислотами (“Прогестеміл”, “Аліментом”, “Портаген”). Необхідне додаткове призначення жиророзчинних вітамінів. Дж. Хиуті та С. Деухерті (1990) рекомендують такі дози: вітамін А – 5000-25000 од на добу; вітамін Е – 25-50 од/кг на добу; вітамін К – 2,5-5,0 мг х 1-2 рази на тиждень; холекальциферол 2500-5000 од на добу.
Профілактика:
Невідома. Бажана генетична консультація.
Спеціальні рекомендації:
Рання діагностика і портоентеростомія покращують прогноз. Портоентеростомія проведена після 3-х місячного віку звичайно є безуспішною.
Номер з каталогу МІМ:
210500 Biliary Atresia, Extrahepatic; EHBA
Література:
- Cormi R, Heil CA, Karrer FM. Extrahepatic Biliary Atresia And Associated Anomalies. Am S Med Genet. 1993;45:683-693.
- Cunningham ML, Sybert VP. Idiopatic Extrahepatic Biliary Atresia. Am J Med Genet. 1988;31:421-426.
- Danesino C, Spadoni E, Buzzi A. Familial Biliary Atresia. Am J Med Genet. 1999;85:195.
- Howard ER. Surgery For Biliary Atresia. Current Paediatrics. 1995;5:28-31.
- Ісаков Ю.Ф. Абдомінальна хірургія у дітей. Москва: Медицина, 1988.
- Шабалов Н.Т. Неонатология. Санкт-Петербург, 1997.- II том.- C. 95-98.
Переглянуто редакційною колегією I.B.I.S.: 13/02/2004
Дивіться також:
Атаксія – телеангіектазія
(Ataxia – Telangiectasia)
Т.В. Краснопера
Спеціаліст з інформаційного забезпечення Хмельницького Центру
Українсько-Американської Програми запобігання вродженим вадам розвитку
Що таке атаксія-телеангіектазія?
Атаксія-телеангіектазія (А-Т) – це рідкісне прогресуюче нейро-дегенеративне захворювання дитячого віку, що впливає на нервову та інші системи організму. Перші ознаки хвороби, до яких належать порушення рівноваги та невиразне мовлення, зазвичай, виявляються протягом перших 10 років життя.
Ознаками А-Т є:
- атаксія (недостатність м’язового контролю) та телеангіектазія (розширення дрібних судин);
- підвищена схильність до лейкемії, лімфоми та впливу радіації;
- ослаблена імунна система, що робить їх особливо вразливими до рецидивуючих легеневих інфекцій.
Яка дослідницька робота проводиться?
Лікарі, які займаються діагностикою та лікуванням А-Т, нещодавно виявили ген, пошкодження якого, ймовірно, і є причиною захворювання. Вивчення гену А-Т допоможе більш точно діагностувати хворобу та розробити ефективне лікування.
Які симптоми захворювання?
Атаксія–телеангіектазія вражає надзвичайно велику кількість систем організму. Перші ознаки хвороби, зазвичай, виявляються на другому році життя. Цими першими ознаками є, як правило, порушення рівноваги, “хитка” хода та нечітка вимова, що зумовлене “атаксією”, тобто ураженням м’язового контролю.
Атаксія. Поява ознак атаксії є початком прогресуючої дегенерації частини мозку, відомої як мозочок, що поступово веде до загальної відсутності м’язового контролю і врешті-решт приковує хворого до інвалідного візка. У зв’язку з подальшим погіршенням стану, викликаним атаксією, діти з А-Т втрачають здатність писати, їх мова також уповільнюється та стає невиразною. Навіть читання стає неможливим, оскільки хворому важко контролювати рухи очей.
Телеангіектазія. Незабаром після появи ознак атаксії, у хворого на А-Т виявляються інші клінічні ознаки захворювання: “телеангіектазія” або сітка розширених судин, які з’являються у кутиках очей чи на поверхні вух чи щік, відкритих сонячним променям. Хоча ця телеангіектазія сама по собі нешкідлива, її виняткова поява разом з атаксією і дала назву хворобі “Атаксія–Телеангіектазія”.
Проблеми з імунною системою. У більшості дітей (70%), хворих на А-Т, є ще одна клінічна ознака: імунодефіцит, який часто призводить до повторних респіраторних інфекцій. Ці інфекції можуть загрожувати життю багатьох пацієнтів. У зв’язку з низьким рівнем імуноглобулінів А та Е, які є природними антиінфекційними речовинами крові, діти, хворі на А-Т, сприйнятливі до легеневих інфекцій, погано реагують на традиційне лікування антибіотиками. Поєднання ослабленої імунної системи та прогресуючої атаксії може призвести до запалення легенів з фатальним кінцем.
Схильність до ракових захворювань. Діти, хворі на А-Т, мають у 1000 разів більший ризик розвитку злоякісних утворень крові. Лімфома та лейкемія зустрічаються особливо часто, хоча також збільшується кількість випадків інших видів раку. Надзвичайна чутливість до радіації не дозволяє пацієнтам з А-Т переносити радіотерапію, яку призначають в таких випадках онкологічним хворим.
Які інші риси А-Т?
Атаксія–телеангіектазія може поєднуватись з цукровим діабетом, передчасним посивінням, утрудненим ковтанням, що викликає задуху та/або витікання слини, а також затримкою зросту. Хоча А-Т і є мультисистемним розладом, діти, уражені цією хворобою, мають і зберігають нормальний або навіть вищий рівень інтелекту. Їхня поведінка, здається, залишається врівноваженою і допомагає зберегти здорове сприйняття життя, незважаючи на прогресуючу слабкість.
Як часто зустрічається А-Т?
Атаксія–телеангіектазія не визнає расових, економічних, географічних чи освітніх бар’єрів. Однаково часто вражаються чоловіки і жінки. Епідеміологи визначають частоту А-Т як 1 на 40 000 новонароджених. Проте вважається, що більшості дітей з А-Т, особливо тим, хто помер у ранньому віці, так і не було поставлено правильний діагноз. Таким чином, може виявитись, що ця хвороба не така вже рідкісна.
Який прогноз захворювання?
Несприятливий. На даний час А-Т не лікується і стан хворих не можна полегшити. Якщо не розвивається рак, то більшість дітей з А-Т до 10 років потрапляють на інвалідні візки, але не тому, що їх м’язи слабкі, а тому, що вони не можуть їх контролювати. Пізніше пацієнти з А-Т, як правило, помирають від дихальної недостатності чи раку ще до повноліття. Випадки, коли пацієнти з А-Т дожили до сорока років, трапляються, але надзвичайно рідко.
Які способи лікування А-Т існують?
Ліків від А-Т немає, і на даний час не існує засобу уповільнення прогресування хвороби. На сьогодні лікарські препарати використовуються для часткового полегшення певних симптомів, коли вони проявляються. Через те, що А-Т рідкісне захворювання, фармацевтичні дослідження недостатні, щоб допомогти дітям з А-Т. Фізіотерапія, трудотерапія та логопедичні заняття використовуються для підтримки еластичності, ін’єкції гамаглобуліну допомагають підтримати імунну систему хворих на А-Т, незначний ефект досягається також великими дозами вітамінів.
Чи є зв’язок А-Т з іншими хворобами?
Вчені погоджуються, що дослідження проблеми А-Т на молекулярному та клітинному рівнях має велике значення для громадськості, оскільки висвітлює причини розвитку раку, неврологічних та імунних дефектів. Таким чином, фінансування досліджень по А-Т приносить користь значній кількості людей, а не лише хворим на А-Т дітям.
Наприклад, нещодавно вчені виявили, що АТМ-протеїн взаємодіє з генетичним продуктом гена “p53”, який є дефективним у більшості ракових пухлин. Біологи, що вивчають пухлини, таким чином розглядають А-Т як одну з моделей для вивчення спадкової схильності до онкологічних захворювань. Виявилося, що ген А-Т також взаємодіє з геном “ВРКА 1”, що відповідає за сімейне накопичення раку молочної залози. Подібно до цього, хромосомна нестабільність у соматичних клітинах дітей, хворих на А-Т, проливає світло на механізм виникнення мутації, а внаслідок цього і розвитку лейкемії, лімфом та інших видів раку. Мутація у гені А-Т порушує нормальний розвиток вилочкової залози – основного органу імунної системи. Розуміння того, як розвивається імунодефіцит у людей з А-Т, може мати відношення до інших імунодефіцитів, можливо, включно з СНІД.
Доктор Елена Бодер, лікар і відомий дослідник, яка у 1957 році й дала назву А-Т, сказала про комплексну природу захворювання так: “А-Т це не просто рідкісне захворювання. Воно потрапило в центр міжнародних досліджень, оскільки має риси, які є головною турботою медицини на сьогодні: схильність до раку, імунодефіцит, прогресуюче неврологічне погіршення та передчасне старіння. Можливо, А-Т зможе виявити, як вони пов’язані”.
Багато дослідницьких технологій, розроблених і використовуваних дослідниками А-Т, можуть бути перенесені на вивчення інших хвороб. Наприклад, нові генетичні “маркери”, виявлені на 11 хромосомі під час пошуку А-Т, тепер допоможуть генетикам знайти дорогу до генів інших хвороб.
Іншим прикладом може бути те, що клітини мозку, які відмирають у хворих на А-Т, відмирають і в хворих на інші неврологічні розлади, такі, як хвороба Альцгеймера. Таким чином, прогрес, досягнутий дослідниками А-Т у вивченні відмирання мозкових клітин, матиме значення для дослідження інших хвороб. Нещодавно вчені виявили, що у мозку мишей, хворих на А-Т, нейрони, що виробляють допамін, відмирають так само, як і при хворобі Паркінсона.
Як успадковується А-Т?
Організм кожної людини складається з дрібних частинок, які називають клітинами. Кожна клітина має повний набір інструкцій про те, що робити і як змусити працювати людський організм. Ці інструкції називають генами, які утворені з хімічної речовини, що називається ДНК. Гени зазвичай парні і саме вони визначають всі ознаки нашого організму. Наприклад, певні гени визначають колір наших очей, тоді як інші – тип крові.
Гени часто називають одиницями спадковості, оскільки містять інформацію, яка передається від одного покоління іншому. Кожен з нас успадковує один з пари генів від матері, а інший – від батька. Тому наш організм працює з комбінацією інструкцій, успадкованих від обох батьків. Батьки не можуть контролювати процес передачі генів дітям.
А-Т називають рецесивною генетичною хворобою, оскільки у батьків її симптоми не виявляються, але кожен з них є носієм рецесивного гена, який і може викликати захворювання на А-Т у їх нащадків. Отже, неможливо передбачити генетичний шлях А-Т, і найчастіше дитина із А-Т стає шоком для батьків. Рецесивний ген може “мовчати”, не проявляючись, в багатьох поколіннях. У носіїв гена А-Т існує шанс 1:4 (ризик 25%) мати потомство з А-Т. А кожна здорова дитина таких батьків з вірогідністю 2:3 (ризик 66%) буде носієм гена А-Т, як і її батьки.
Як діагностується А-Т?
Для лікаря, що має досвід лікування пацієнтів з А-Т цілком реально встановити діагноз на основі клінічних проявів та огляду. Але, оскільки більшість лікарів ніколи не зустрічалися з хворобою, існує дуже велика вірогідність помилок.
Можливо в зв’язку з назвою хвороби лікарі, що оглядають дітей з атаксією, дуже часто виключають можливість А-Т, якщо відсутня телеангіектазія. Між тим телеангіектазія часто не виявляється до шестирічного віку, а іноді ще пізніше. Подібно до цього, підозри на А-Т зростають при наявності повторних легеневих інфекцій, але у близько 30% випадків проблем з імунітетом немає.
Найбільш розповсюджений помилковий ранній діагноз – статична енцефалопатія (або так званий атактичний церебральний параліч). Навіть якщо атаксія та порушення ходи – симптом, який практично завжди виявляється при А-Т – повільно і неухильно прогресує, це може компенсуватися нормальним розвитком моторних навичок у віці від 2 до 5 років, таким чином маскується розвиток атаксії і складається враження покращення стану хворого. В результаті цього, поки прогресування хвороби не стане явним, клінічний діагноз буде неправильним і непевним, якщо тільки у хворого не буде брата чи сестри з А-Т.
Як тільки прогресування хвороби стане явним, найбільш розповсюдженим хибним діагнозом буде атаксія Фрідрейха. Хоча атаксія Фрідрейха зазвичай має пізніші прояви, а також характерними є кіфосколіоз. Спінальні симптоми, включно з ураженням задніх рогів спинного мозку разом з вираженим симптомом Ромберга, відрізняють цей тип спінальної атаксії від первинної мозочкової атаксії при А-Т.
Які лабораторні маркери А-Т існують?
На щастя, будь які труднощі з диференціальною діагностикою можуть бути легко розв’язані при звертанні до лабораторії. Найбільш стійким лабораторним маркером А-Т є підвищений вміст альфафетопротеїну в сироватці крові після 2-річного віку. Підтвердженням діагнозу також можуть бути низькі рівні гемоглобіну А, G та/або Е у сироватці крові.
Наявність спонтанних хромосомних розривів та перегрупувань у лімфоцитах в штучних умовах та у культивованих шкірних фібробластах клітинах шкіри, хоч і не обов’язково присутня, але також є важливим лабораторним маркером А-Т. І, нарешті, знижений рівень виживання лімфоцитних та фібробластних культур, після впливу на них іонізуючої радіації, підтвердить діагноз А-Т, хоча ця, переважно, дослідницька технологія поки не застосовується в широкій лікарській практиці.
Чи є генетичні тести для підтвердження діагнозу?
Оскільки на сьогодні мутований А-Т ген (АТМ) вже визначений науковцями, науково можливо підтвердити діагноз шляхом скринінгу ДНК пацієнта на предмет мутацій. На жаль, лише обмежена кількість лабораторій може надати подібну послугу.
Можливі симптоми А-Т:
- прогресуюча мозочкова атаксія (хоча у віці від 2 до 5 років атаксія може здаватися статичною);
- прогресуюча телеангіектазія на шкірі та склерах, що розвивається до 6-річного віку;
- схильність до розвитку раку;
- характерне гіпотонічне обличчя;
- прогресуюче порушення рухів очей;
- відсутність чи дисплазія вилочкової залози;
- хореоатетоз;
- затримка зросту;
- мозочкова дизартрія та слинотеча;
- стійка поведінка;
- ендокринні відхилення;
- схильність до інсулінорезистентного діабету в підлітковому віці;
- прогеричні (старечі) зміни волосся, шкіри, судин;
Можливі маркери А-Т:
- підвищений вміст альфафетопротеїну в сироватці крові після 2-річного віку;
- підвищений рівень онкофетального антигену в плазмі крові;
- низькі рівні інсуліну А, Г та/або Е у сироватці крові;
- наявність спонтанних хромосомних розривів та перегрупувань у лімфоцитах в штучних умовах та в культивованих шкірних фібробластах шкіри;
- знижений рівень виживання лімфоцитних та фібробластних культур, після впливу на них іонізуючої радіації.
Переглянуто редакційною колегією I.B.I.S.: 8/05/2003
Дивіться також:
Атрезія піхви
(Vaginal Atresia)
Олена Анатоліївна Турович
Лікар УЗД, лікар-генетик
Рівненського обласного медико-генетичного центру
Рівненського обласного клінічного лікувально-діагностичного центру ім. В. Поліщука
Включення:
- Вагінальна атрезія, одна з форм “вродженої відсутності піхви”.
Виключення:
- Атрезія гімену;
- Всі форми жіночого псевдогермафродитизму;
- Всі форми чоловічого псевдогермафродитизму;
- Аплазія мюлерових протоків;
- Аномалії нирок, статевих органів і середнього вуха.
Мінімальні діагностичні критерії:
Атрезія нижнього відділу піхви у жінок (46,ХХ) з нормальним розвитком верхньої частини піхви, матки, зовнішніми статевими органами та яєчниками.
Клінічні ознаки:
Нижній відділ піхви (1/3-1/5) заміщені на 2-3 см фіброзно-волокнистою тканиною. Верхня частина піхви залишається добре диференційованою. Зовнішні (статеві губи) та внутрішні статеві органи (шийка матки, матка, фаллопієві труби та яєчники) є анатомічно нормальними. Зазвичай соматичні аномалії відсутні, хоча іноді траплялись і аномалії нирок. В періоді статевого дозрівання вторинні статеві ознаки розвиваються нормально, за вийнятком відсутності менструацій.
Ускладнення:
Атрезія піхви перешкоджає виділенням, менструальні виділення не можуть пройти через атретичну піхву. Гідрометрокольпос може призвести до аменореї, а також до абдомінальних болей чи пухлиноподібного утвору, який виникає внаслідок накопичення виділень.
Поєднані аномалії: зустрічаються ниркові аномалії.
Етіологія:
Невідома. Сімейні випадки спостерігаються рідко. Ймовірно мультифакторіальна етіологія.
Патогенез:
Каудальна (задня) частина піхви формується як інвагінація сечостатевого синусу, а краніальна (верхня) частина має мюлерівське походження. При вагінальній атрезії сечостатевий синус ймовірно не в змозі підтримувати каудальну (задню) частину піхви.
Співвідношення статей: Ч0 : Ж1.
Ризик повторення: низький.
Вік виявлення:
Зазвичай у періоді статевого дозрівання через те, що гідрометрокольпос є причиною аменореї. Іноді мукокольпос трапляється у новонароджених.
Частота:
Зустрічається приблизно у 5-10% осіб жіночої статі з “відсутньою піхвою”.
Первинна профілактика: медико-генетичне консультування.
Лікування:
Хірургічне видалення фіброзно-волокнистої тканини.
Прогноз:
Нормальна тривалість життя та нормальна здатність до відтворення потомства.
Диференційний діагноз:
Необхідно проводити диференційну діагностику з аплазією мюллерових протоків, при якій краніальна (верхня) частина піхви та матка відсутні. Вагінальна атрезія спостерігається при аутосомно-рецесивному синдромі, що супроводжується також гіпоплазією або агенезією нирок та аномаліями середнього вуха.
Номер з каталогу МІМ:
277000 Mayer-Rokitansky-Kuster-Hauser Syndrome.
Переглянуто редакційною колегією I.B.I.S.: 1/04/2008
Атаксія Фрідрейха
(Friedreich Ataxia)
В.В. Кривіцька
Зав. реабілітаційним центром “Турбота”,
Хмельницька область
Атаксія Фрідрейха – одна з найпоширеніших форм спадкових атаксій.
У 1862 р. N. Fridreich вперше описав основні риси захворювання, спостерігаючи 6 випадків у двох сім’ях. У своїх роботах у 1863-1877 роках він виділив її із групи локомоторних атаксій і вона отримала назву “атаксія Фрідрейха” чи сімейна атаксія Фрідрейха.
А.Вагвсам запропонував в 1982 р. термін “хвороба Фрідрейха”, який відображає множинність неврологічних та екстраневральних проявів.
Хвороба Фрідрейха і в наш час залишається найбільш чітко визначеною клінічно та анатомічно формою спадкових атаксій.
Діагноз базується на основі:
- клінічних симптомів (неврогенних та екстраневральних);
- даних обстежень: магнітно-ядерне сканування, комп’ютерна томографія;
- УЗД (Ехо-кардіографія);
- електрофізіологічних (ЕКГ, електронейроміографія);
- лабораторних даних (гематологічних, ДНК-діагностика).
Основні критерії:
- аутосомно-рецесивний тип успадкування;
- дебют в підлітковому, рідше в юнацькому віці;
- атаксія, арефлексія, порушення глибокої чутливості, слабкість та атрофія м’язів ніг, пізніше рук;
- екстраневральні прояви;
- скелетні деформації: сколіоз, кіфосколіоз, стопа Фрідрейха, деформація пальців ніг та рук;
- ендокринні розлади: цукровий діабет, гіпогонадизм, інфантилізм, дисфункція яйників;
- кардіоміопатія (гіпертрофічна, рідше дилятаційна); зміни на ЕКГ, Ехо-КГ;
- катаракта;
- атрофії спинного мозку, видимі на МР-томограмах;
- ДНК-діагностика.
Симптоми:
Неврологічні:
- Порушення координації (невпевненість, незграбність), хода п’яного, невпевнена хода, особливо в темряві;
- Сенситивна атаксія, яка поєднується з порушенням суглобово-м’язової та вібраційної чутливості, і залежить від зорового контролю за рухами (вражаються задні канатики спинного мозку);
- Мозочкова атаксія (гіперметрія, інтенційний тремор, скандована мова, адіадохокінезія, ністагм), атаксія посилюється при закриванні очей (вражаються бокові канатики);
- Зниження аж до повної арефлексії (сухожилкових та надкісничних рефлексів, колінних, ахілових), що може на декілька років випередити маніфестацію хвороби;
- Поява симптому Бабінського;
- Слабкість та атрофія м’язів ніг, пізніше аміотрофія, розлади глибокої чутливості;
- Дискоординація в руках, зміна почерку;
- Зміна мови – повільна (дизартрія);
- Психічні розлади.
Екстраневральні:
- Прогресуюча кардіоміопатія у 50-75% пацієнтів (гіпертрофічна, в деяких випадках дилятаційна):
- задишка при навантаженні, болі в області серця, систолічний шум, серцебиття;
- Скелетні деформації:
- сколіоз, кіфоз;
- стопа “Фрідрейха” – 50-75% (високе, вигнуте склепіння стопи, перерозгинання пальців в основних фалангах, згинання в дистальних);
- деформація пальців рук, ніг;
- Ендокринні порушення (цукровий діабет, гіпогонадизм, інфантилізм, дисфункція яйників);
- Катаракта.
Особливості клінічного перебігу:
- характерний прогресуючий перебіг протягом 20 років, причиною смерті є серцева або легенева недостатність, інфекційні ускладнення;
- можливий початок в більш пізньому віці – 20-30 років, з повільнішим перебігом;
- можуть бути відсутні типові зміни серця, цукровий діабет;
- часто у різних хворих відмічаються малі ознаки хвороби (деформована стопа, симптом Бабінського та інші).
Дані обстежень:
-
- МР-томографія – атрофія спинного мозку (на ранній стадії):
- помірно виражена атрофія продовгуватого мозку, містка, мозочка (рання стадія);
- Комп’ютерна томографія – мало інформативна, так як не дозволяє відстежити зміни спинного мозку на ранніх етапах:
- незначна атрофія мозочка в деяких випадках або відсутність змін (пізня стадія);
- атрофія півкуль та хробака мозочка;
- розширення 4-го шлуночка, стовбурових цистерн, бокових шлуночків та субарахноїдальних просторів великих півкуль.
- МР-томографія – атрофія спинного мозку (на ранній стадії):
Ступінь цих змін незначний навіть у важко хворих пацієнтів.
- Електронейроміографія – відсутність або значне зниження амплітуди потенціалів дії чутливих нервів кінцівок при порівняно незначному пониженні швидкості проведення імпульсу по рухових нервах.
- ЕКГ – порушення ритму, інверсія зубця Т, порушення передсердно-шлуночкової та внутрішньошлуночкової провідності.
- Ехо-ЕКГ – гіпертрофічна або дилятаційна кардіоміопатія.
- Рентгенографічне обстеження хребта виявляє наявність кісткових деформацій (сколіози, кіфози, кіфосколіози).
Лабораторно:
- гематологічно – визначення рівня глюкози в крові (навантажувальні тести толерантності до глюкози);
- генетичне картування – ген хвороби Фрідрейха локалізований в центромерній ділянці 9-ї хромосоми в локусі 9q 13-q-21;
- ДНК – діагностика, в тому числі і рання пренатальна діагностика;
- діагностика гетерозиготного носійства мутантного гена.
Диференційний діагноз:
- Спадкова атаксія зумовлена дефіцитом вітаміну Е та близьким до неї синдромом Бассена-Корнцвейга:
- визначення рівня вітаміну Е в крові, ліпідний профіль крові, мазок крові на акантоцитоз;
- Спадкові обмінні захворювання, які характеризуються розвитком спинно-церебелярної атаксії: Gm1-Gm2-гангліозидаз та галактосіалідоз: – обстеження активності бета-галактозидази, гексозамінідази А:
- Хвороба Краббе: дефіцит фермента галактозілцерамідази;
- Хвороба Німана-Піка:
- обстеження наявності сфінгомієлінів у лікворі;
- обстеження стернального пунктату на наявність “пінистих клітин”.
- Розсіяний склероз: нехарактерна сухожилкова арефлексія, м’язова гіпотонія, аміотрофія, екстраневральні прояви. Для хвороби Фрідрейха не характерні періоди ремісій та вогнищеві зміни мозку на КТ та МР-томографії.
Етіологія:
Ген-кандидат – FDRA – Frataxin (606829), розташований на 9q13-q21.1, містить 7 екзонів.
Переважна експресія – у позаневральних тканинах – серце, скелетна мускулатура, печінка, нирки, підшлункова залоза.
У центральній нервовій системі (у порядку зменшення) – спинний мозок, мозочок, кора головного мозку.
Гомолог Frataxin у дріжджів відіграє роль у метаболізмі заліза. Мутації у гені Frataxin призводять до накопичення заліза у мітохондріях.
Патогенез:
Секвестроване залізо стає недоступним для залізовмісних протеїнів, що приводить до дестабілізації, зниження активності Fe-S-вмісних субодиниць мітохондріальних комплексів І, ІІ, ІІІ та аконітази, накопичення кисневих радикалів та реалізації окислювального стресу. Дефіцит Frataxin (абсолютний чи відносний) спричиняє накопичення токсичного вільного заліза в мітохондріях, знижуючи їх мембранний потенціал, що також пояснює механізм загибелі клітин при атаксії Фрідрейха.
Інші захворювання з порушенням метаболізму заліза:
- хвороба Гентингтона;
- церулоплазмінемія;
- aцерулоплазмінемія;
- нейродегенерації з накопиченням заліза у корі головного мозку (дефіцит пантотенат кінази 2, дефіцит ферритин поліпептидази).
Експансія тринуклеотидних повторів (GAA) в інтроні 1 – найчастіша мутація (98%). Нормальна кількість GAA-повторів від 6 до 34 (6-12 у 83%, 14-34 – у 17%). При атаксії Фрідрейха – від 67 до 1700, найчастіше 800–1000 копій. Довжина GAA-повторів може збільшуватись або зменшуватись. Чим довший повтор, тим він нестабільніший в мейозі та мітозі. При материнській передачі збільшення або зменшення довжини повторів відбувається з однаковою частотою, при батьківській передачі – довжина повторів зменшується.
Точкові мутації (2%). Описано 17 різноманітних точкових мутацій, як правило, гетерозиготних з геном GAA-повторів, досі не ідентифіковано гомозиготної точкової мутації.
Кореляція генотип – фенотип. Клінічні симптоми корелюють з довжиною GAA-повторів: обернено пропорційно з віком початку захворювання (м’який перебіг, пізній дебют захворювання спостерігається при довжині повторів до 500 пар основ; довші повтори – частіше проявляються кардіопатією, втратою рефлексів з рук, раннім початком захворювання).
Псевдодомінантний тип успадкування може спостерігатись завдяки манфестації носійства у батька (дебют після 40 років) або при високому індексі носійства.
Проміжна кількість повторів (120-156) корелює зі спастичною атаксією, початком захворювання у 38-45 років.
Мутації у карбоксильній частині Frataxin (міссенс) зумовлює виражені прояви атаксії Фрідрейха.
Міссенс мутації в амінокінці Frataxin – атиповий та м’який перебіг.
Компаунд гетерозигот: найбільш характерна атрофія зорових нервів.
Оскільки атаксія Фрідрейха успадковується аутосомно-рецесивно, не спостерігається типовий для динамічних мутацій ефект антиципації.
Поширеність: 1 : 50000.
Носійство: 1 : 60-110, низька частота в Азії, Африці.
Співвідношення статі: Ч1 : Ж1.
Патоморфологічні зміни:
- дегенерація, демієлінізація (з проростанням глії) задніх та бокових канатиків спинного мозку. Особливо вражається тонкий пучок, передній та задній спинно-мозочкові шляхи, перехрещений, пірамідний;
- в меншій мірі мозочок (зубчасте ядро, верхні ніжки);
- деколи знаходять зміни в задніх корінцях периферичних нервів;
- в пізній стадії відмічається дегенерація ядер черепно-мозкових нервів, клітин Пуркін’є;
- інколи зміни в великих півкулях мозку.
Лікування: симптоматичне.
- кардіоміопатія – idebenone – 5-10 мг/кг в день (при гіпертрофічній кардіоміопатії);
- препарати, що покращують тканинний обмін – ноотропи, церебрум-композитум, траумель С. вітамінотерапія;
Кінезотерапія – комплекс вправ, направлених на корекцію координаторних порушень.
Запобігання повторних випадків шляхом проведення медико-генетичного консультування у сім’ях, де є уражені особи, з проведенням комплексу генетичних обстежень, інвазивна пренатальна діагностика.
Пренатальна діагностика:
З використанням МСТ112 ДНК-маркера чи фланкуючих маркерів, котрі дозволяють підвищити достовірність пренатальної діагностики до 100%.
Номер з каталогу МІМ:
229300 Friedreich Ataxia 1; FRDA.
Література:
- Карпов В.А. Клинический анализ последственных мозжечковых атрофий.- 1998.
- Ackroyd, R. S.; Finnegan, J. A.; Green, S. H.: Friedreich’s ataxia: a clinical review with neurophysiological and echocardiographic findings. Arch. Dis. Child. 59: 217-221, 1984.
- Barbeau, A.; Roy, M.; Sadibelouiz, M.; Wilensky, M. A.: Recessive ataxia in Acadians and ‘Cajuns.’. Canad. J. Neurol. Sci. 11: 526-544, 1984.
- Campanella, G.; Filla, A.; De Falco, F.; Mansi, D.; Durivage, A.; Barbeau, A.: Friedreich’s ataxia in the south of Italy: a clinical and biochemical survey of 23 patients. Canad. J. Neurosci. 7: 351-357, 1980.
- D’Angelo, A.; Di Donato, S.; Negri, G.; Beulche, F.; Uziel, G.; Boeri, R.: Friedreich’s ataxia in northern Italy: I. Clinical, neurophysiological and in vivo biochemical studies. Canad. J. Neurosci. 7: 359-365, 1980.
- Dean, G.; Chamberlain, S.; Middleton, L.: Friedreich’s ataxia in Kathikas-Arodhes, Cyprus. (Letter) Lancet II: 587 only, 1988.
- Elias, G.: Muscular subaortic stenosis and Friedreich’s ataxia. Am. Heart J. 84: 843, 1972.
- Fernandez, R. J.; Civantos, F.; Tress, E.; Maltese, W. A.; De Vivo, D. C.: Normal fibroblast mitochondrial malic enzyme activity in Friedreich’s ataxia. Neurology 36: 869-872, 1986.
- Geoffroy, G.; Barbeau, A.; Breton, G.; Lemieux, B.; Aube, M.; Leger, C.; Bouchard, J. P.: Clinical description and roentgenologic evaluation of patients with Friedreich’s ataxia. Canad. J. Neurol. Sci. 3: 279-286, 1976.
- Hanna, M. G.; Davis, M. B.; Sweeney, M. G.; Noursadeghi, M.; Ellis, C. J.; Elliot, P.; Wood, N. W.; Marsden, C. D.: Generalized chorea in two patients harboring the Friedreich’s ataxia gene trinucleotide repeat expansion. Mov. Disord. 13: 339-340, 1998.
- Keoppen, A. H.; Goedde, H. W.; Hirth, L.; Benkmann, H.-G.; Hiller, C.: Genetic linkage in hereditary ataxia. (Letter) Lancet I: 92-93, 1980.
- Kirkham, T. H.; Coupland, S. G.: An electroretinal and visual evoked potential study in Friedreich’s ataxia. Canad. J. Neurol. Sci. 8: 289-294, 1981.
- Lander, E. S.; Botstein, D.: Homozygosity mapping: a way to map human recessive traits with the DNA of inbred children. Science 236: 1567-1570, 1987.
- Monros, E.; Smeyers, P.; Ramos, M. A.; Prieto, F.; Palau, F.: Prenatal diagnosis of Friedreich ataxia: improved accuracy by using new genetic flanking markers. Prenatal Diag. 15: 551-554, 1995.
- Palau, F.; De Michele, G.; Vilchez, J. J.; Pandolfo, M.; Monros, E.; Cocozza, S.; Smeyers, P.; Lopez-Arlandis, J.; Campanella, G.; Di Donato, S.; Filla, A.: Early-onset ataxia with cardiomyopathy and retained tendon reflexes maps to the Friedreich’s ataxia locus on chromosome 9q. Ann. Neurol. 37: 359-362, 1995.
- Puccio, H.; Koenig, M.: Recent advances in the molecular pathogenesis of Friedreich ataxia. Hum. Molec. Genet. 9: 887-892, 2000.
- Raimondi, E.; Antonelli, A.; Driesel, A. J.; Pandolfo, M.: Regional localization by in situ hybridization of a human chromosome 9 marker tightly linked to the Friedreich’s ataxia locus. Hum. Genet. 85: 125-126, 1990.
- Sakamoto, N.; Chastain, P. D.; Parniewski, P.; Ohshima, K.; Pandolfo, M.; Griffith, J. D.; Wells, R. D.: Sticky DNA: self-association properties of long GAA-TTC repeats in R-R-Y triplex structures from Friedrich’s ataxia. Molec. Cell 3: 465-475, 1999.
- Tan, G.; Chen, L.-S.; Lonnerdal, B.; Gellera, C.; Taroni, F. A.; Cortopassi, G. A.: Frataxin expression rescues mitochondrial dysfunctions in FRDA cells. Hum. Molec. Genet. 10: 2099-2107, 2001.
- Ulku, A.; Arac, N.; Ozeren, A.: Friedreich’s ataxia: a clinical review of 20 childhood cases. Acta Neurol. Scand. 77: 493-497, 1988.
Переглянуто редакційною колегією I.B.I.S.: 8/05/2003
Атаксія-телеангіектазія
(Ataxia – Telangiectasia)
Тетяна Василівна Тіткова
Лікар-невролог
дитячої поліклініки № 3 м. Рівне
Включення:
- Cиндром Бодер-Седжвіка;
- Синдром Луї-Бар;
- Телеангіектазія і атаксія.
Виключення:
- Атаксія без імунологічного дефіциту;
- Телеангіектази без імунологічного дефекту;
- Дефіцит імуноглобуліну А.
Основні критерії:
Атаксія, телеангіектазії, рецидивуючі інфекції верхніх дихальних шляхів, зниження рівня або відсутність IgA, імунодефіцит.
Клінічні ознаки:
Перші ознаки з’являються на другому році життя у вигляді порушень ходи (“хода клоуна”, “хода півня”) з поступовим приєднанням інших ознак: дизартрії, м’язової гіпотонії, дизметрії, інтенційного тремору. Типовим симптомом хвороби є окорухові розлади. У подальшому картину атаксії доповнюють екстрапірамідні розлади з хореоатетозом та паркінсоноподібною симптоматикою. У 50% хворих після 10-річного віку відмічається інтелектуальний регрес.
Телеангіектазії здебільшого зявляються на 3-5-му роках життя і прогресують з віком, захоплюючи бульбарну кон’юнктиву повіки, крила носа, вуха, інші, переважно відкриті, ділянки шкіри. Згодом з’являються посивіння волосся, атрофічні зміни шкіри, ділянки гіпо- і гіперпігментації.
Діти відстають у фізичному розвитку. В осіб жіночої статі спостерігаються порушення менструальної функції та фертильності.
Комбінований імунодефіцит проявляється системною гіпоплазією лімфоїдної тканини лімфовузлів, мигдаликів, тимусу та рецидивуючими важкими рино-сино-бронхолегеневими запальними процесами. Підвищена чутливість пацієнтів до іонізуючої радіації та УФО асоціюється з високим ризиком розвитку пухлин.
Асоційовані вади:
Дизгенезія гонад, атрофія яєчок, затримка фізичного розвитку, дисфункція печінки.
Дані обстежень:
- КТ головного мозку – гіпоплазія мозочка; рівномірне розширення субарахноїдального простору і шлуночкової системи; зниження щільності в базальних ядрах.
- МРТ головного мозку – гіпоплазія мозочка, переважно черв’яка; атрофія мозочка і розширення четвертого шлуночка; зниження щільності в ділянці базальних ядер.
- Імунний статус – різке зниження або відсутність імуноглобулінів класу A, E, G; у 45% хворих виявляються аутоантитіла до м’язів, мітохондрій, біліарних канальців, тиреоглобуліну. Підвищений рівень α-фетопротеїну і карциноембріонального комплексу. Первинна недостатність вилочкової залози.
- Цитогенетичний аналіз лімфоцитів – знахідки інверсії 7 хромосоми та транслокацій 7 і 14 хромосом. Найчастіше у перебудови залучаються ділянки 7p13, 7q35, 14q11, 14q32, які є локусами рецепторів Т-клітин та важких ланцюгів імуноглобулінів.
- Молекулярно-генетичний аналіз – виявлення мутації гена АТМ у зразках ДНК лейкоцитів периферичної крові або пренатального матеріалу.
Рекомендації щодо раннього виявлення атаксії-телеангіектазії:
- визначення рівня α-фетопротеїну в сироватці крові в усіх пацієнтів з атаксією на другому році життя;
- визначення рівня α-фетопротеїну в сироватці крові в усіх випадках поєднання частих рино-сино-бронхопульмональних захворювань з неврологічними розладами;
- консультація лікаря-імунолога в усіх випадках підвищеного рівня α-фетопротеїну в сироватці крові хворих на атаксію або інші неврологічні розлади;
- селективний скринінг атаксії-телеангіектазії в контингенті пацієнтів онкогематологічних відділень;
- проведення інвазивної пренатальної діагностики стану плода в сім’ях високого ризику.
Диференційний діагноз:
Атаксія Фрідрейха, гепатолентикулярна дегенерація, спадкові невропатії.
Етіологія:
Аутосомно-рецесивний тип успадкування. Ген локалізований в ділянці 11q23.
Частота виникнення:
2-3 на 100000 живонароджених. Гетерозиготні носії складають 1% населення і мають підвищену радіочутливість і схильність до онкологічних захворювань, особливо до раку молочної залози.
Ризик для сибсів: 25%.
Ризик для нащадків: пацієнти не мають дітей.
Співвідношення між статями: Ч1 : Ж1.
Вік прояву:
Перші ознаки з’являються на другому році життя у вигляді порушень ходи. Телеангіектазії здебільшого з’являються на 3–5 році життя і прогресують з віком.
Прогноз:
Прогноз захворювання несприятливий. 15% хворих помирають від злоякісних новоутворів, лімфом і лейкемії. Пацієнти, у яких перебіг захворювання без ускладнень з боку дихальної системи і без наявності новоутворень, можуть прожити до 50 років.
Ускладнення:
Атаксія, хореоатетоз, ністагм, апраксія очних рухів, дизартрія, рецидивуючі бронхолегеневі запальні захворювання, розвиток пухлин.
Профілактика: медико-генетичне консультування.
Пренатальна діагностика:
Інвазивна пренатальна діагностика в сім’ях високого ризику (верифіковані випадки атаксії-телеангіектазії або поєднання неврологічної та онкогематологічної патології серед потомства).
Профілактика ускладнень:
- обмеження променевого навантаження на організм, у тому числі проведення рентгенологічних досліджень, КТ та УФО. При необхідності методом вибору є МРТ;
- дослідження показників клітинного і гуморального імунітету кожні 6 місяців з метою своєчасного призначення замісної терапії та профілактики інфекційних ускладнень;
- протипоказане введення живих вакцин.
Лікування:
Специфічна терапія не розроблена. Проводиться часткова корекція імунного статусу шляхом замісної терапії імуноглобулінами з метою профілактики інфекційних процесів. У випадку онкологічних ускладнень проводиться поліхіміотерапія згідно відповідних протоколів.
Номер з каталогу МІМ:
208900 Ataxia-Telangiectasia; AT
Література:
- Диагностика и лечение наследственных заболеваний нервной системы у детей. Руководство для врачей /Под ред. В.П. Зыкова.– М.: “Триада-Х”, 2007.– С.98–101.
- Додаток до наказу МОЗ України № 355 від 09-07-2004 “Про затвердження Протоколів лікування дітей за спеціальністю “Дитяча імунологія”.
- Козлова С.И., Демикова Н.С., Семанова Е., БлинниковаО.Е. Наследственные синдромы и медико–генетическое консультирование.- М.: Практика, 1996.- C. 318-319.
- Информационная медицинская сеть “Невронет”.
- Наследственые болезни нервной системы: руководство для врачей /Под ред. Ю.Е. Вельтищева, П.А. Гелина.– М.: Медицина,1998.– С.83-86.
- Штульман Д. Р. Неврология: Справочник практ. врача.- 4-е изд., переработаное и дополненое.– М.: МЕДпресс-информ,2005.- С.514.
- Birth Defects Compendium. D. Bergsma (ed.). Second Edition. New York, 1979:129-130.
- Gorlin RJ, Cohen MM, Hennekam RCM. Syndromes of the Head and the Neck. 4th edition. Oxford University Press. 2001:566-570.
- Jones KL. Smith’s Recognizable Patterns of Human Malformations. 6th edition. W.B. Sauders Company. Philadelphia. 2005:213-214.
Переглянуто редакційною колегією I.B.I.S.: 14/10/2010
Дивіться також:
- Атаксія – телеангіектазія (інформація для батьків)
Асфіксична дистрофія грудної клітки
(Asphyxiating Thoracic Dystrophy)
С.А. Бойко
Зав. пологовим відділенням
Зарічненської центральної районної лікарні Рівненської області
Включено:
Синдром Жена і дистрофія грудної клітки Жена, інфантильна дистрофія грудної клітки, торакопельвіафалангеальна дистрофія.
Основні діагностичні критерії:
Найбільш типовою ознакою є вузька дзвоноподібна грудна клітка з короткими горизонтальними ребрами. Ключиці можуть бути вивернуті з характерним розміщенням у формі велосипедного руля. Трубчаті кістки не змінені або злегка вкорочені. Клубові кістки зменшені і уплощені. Зріст низький.
Захворювання має широкий спектр проявів.
Помітне зменшення розмірів грудної клітки призводить до гіпоплазії легень і дихальної недостатності. Спостерігається рання оссифікація епіфізу голівки стегна. Ліктьова і малогомілкова кістки відносно короткі.
Дуже рідко захворювання діагностується випадково, коли при рентгенологічному обстеженні виявляються його характерні ознаки. Конусоподібні епіфізи і раннє зрощення між епіфізами і метафізами дистальних і середніх фаланг.
Етіологія:
Вважають, що захворювання має аутосомно-рецесивний тип успадкування.
Асоційовані аномалії:
Серед сукупних вісцеральних аномалій синдрому – ураження нирок (дисплазія канальців, кистозне розширення збиральних протоків, навколоклубочковий фіброз), печінки (синдром полікистозної печінки, перипортальний фіброз, гіперплазія жовчних протоків), підшлункової залози (інтерстиціальний фіброз). У деяких хворих виявлені дефекти зубів та нігтів, розщілина губи і піднебіння, полідактилія. Однак ці аномалії частіше зустрічаються при синдромі Елліса-Ван-Кревельда і хондроектодермальній дисплазії. Пряма гіпербілірубінемія з затяжною жовтяницею. Повна транспозиція внутрішніх органів. Розумова відсталість.
Пренатальна діагностика:
Є декілька повідомлень про пренатальну діагностику цього захворювання.
Найбільш важливим діагностичним критерієм є гіпоплазія грудної клітки. У всіх випадках захворювання, діагностованого пренатально за допомогою ехографії, визначались ознаки карликовості з вкороченими кінцівками, при чому довжина трубчастих кісток була на два стандартних відхилення меншою від норми для даного гестаційного віку. Провести диференційну діагностику асфіксичної дисплазії грудної клітки з синдромом Елліса-Ван-Кревельда в атипових випадках неможливо. Для першої типова відсутність полідактилії, ектодермальних аномалій, вродженої вади серця. Захворювання часто супроводжується багатовіддям.
Частота:
Зустрічається рідко. У сучасній літературі є повідомлення про 100 випадків захворювання.
Співвідношення статей: Ч1 : Ж1.
Прогноз:
Від цього захворювання в неонатальному періоді помирає 80% дітей через дихальну недостатність та інфекційні ускладнення. Є повідомлення про тривале виживання хворих, які страждали, напевно, легкою формою. З часом внаслідок втягнення в патологічний процес внутрішніх органів може розвиватись ниркова недостатність або цироз печінки.
Акушерська тактика:
Якщо діагноз встановлений в другому триместрі вагітності, слід запропонувати її переривання. Обгрунтування тактики ведення вагітної при виявленні захворювання в третьому триместрі на даний час не розроблене. Напевно, не слід змінювати принципи стандартної акушерської тактики до того часу, поки не буде встановлена прогностична цінність ехографії при гіпоплазії грудної клітки для оцінки ступеню ризику рівня смертності в період новонародженості.
Номер з каталогу МІМ:
208500 Asphyxiating Thoracic Dystrophy 1; ATD1
Література:
- Ромеро Р, Пилу Дж. Пренатальная диагностика вродженных пороков развития плода.- М.: Медицина, 1994.- С. 344-346.
- Asphyxiating Thoracic Dystrophy. OMIM: #208500.
- Jones KL. Smith’s recognizable patterns of human malformation. W.B.Sauders company, California. 1981:340-344.